実験動物のより良い未来を模索する
実験動物のより良い未来を模索する


- 2025.12.10
- 【前島賞】日本獣医学会 優秀発表賞
- 2025.12.08
- 【JCLAM会員限定動画】実験動物における画像診断技術の応用:生命科学の発展と3Rs貢献の両立~岸 和寿 先生(テルモ株式会社)
- 2025.11.12
- 【コラム更新】動物の難治性疾病に対する創薬研究 〜動物の免疫療法について〜今内 覚先生(北海道大学大学院獣医学研究院)
- AVMA2020
- C57BL/6
- Compassion Fatigue
- ENU
- JALAM
- JALAM会員の寄稿
- JCLAM
- SPF
- イベント
- ウェビナー
- エンドポイント
- エンリッチメント
- くすり
- コットンラット
- コラーゲン
- サイエンスコミュニケーション
- シミュレーター
- スタニオカルシン-1
- ドライシッパー
- フォワードジェネティクス研究
- ブタ
- マウス
- ミネラル調節
- モデル動物
- リホーミング
- 代替法
- 前島賞
- 創薬研究
- 動物実験
- 動物福祉
- 動画
- 周術期管理
- 大学
- 学会
- 学術集会優秀発表賞
- 安全性
- 安楽死
- 実験動物
- 審査
- 情報発信
- 教育
- 教育委員会
- 文献紹介
- 海外
- 環境
- 筋ジストロフィー
- 系統
- 老化
- 蚊の退治法
- 食品検査
- 飼育室温度
- 飼育環境
- 麻酔

動物の難治性疾病に対する創薬研究 〜動物の免疫療法について〜
北海道大学大学院獣医学研究院
今内 覚
1. はじめに
近年、動物も衛生環境の改善、飼育環境や食事の改善から急速に長寿化が進んでいます。『家庭どうぶつ白書 2023』(https://www.anicom-page.com/hakusho/)によると、2021年度のイヌの平均寿命は14.2歳、ネコの平均寿命は14.7歳とのことです。2008年度の報告時では、イヌの平均寿命は13.2歳、ネコの平均寿命は13.9歳でしたので、イヌでは+1.0歳、ネコでは+0.8歳寿命が伸びたことになります。驚くことに、急速に延びたイヌのこの寿命の期間は、ヒトの約4歳以上に相当するそうです。
一方で、長寿命化に伴い悪性腫瘍(がん)によって命を落とす動物が増えており、既存の治療法(手術、抗がん剤療法、放射線療法)に加えて新たな治療戦略の開発が望まれています。ヒトの医療では、2014年に登場した抗Programmed death 1(PD-1)抗体「オプジーボ」(ニボルマブ)に代表される免疫チェックポイント阻害薬を用いた免疫療法が次々臨床応用され、悪性黒色腫をはじめとした多くのがん種において著効を示し、現在は免疫療法が第4の治療戦略として確立されています。本免疫療法の特徴の一つは、免疫チェックポイント因子によるがんに対する免疫の抑制機序が同じであれば、異なるがん種であっても同じアプローチ(同じ医薬品)で治療が横断的に可能なところにあります。ヒトの新たながん治療法として道を切り開いた免疫チェックポイント阻害薬開発者の京都大学・本庶 佑先生には、2018年にノーベル生理学・医学賞が授与されています。
我々の研究グループはこれまでに、様々な動物の免疫チェックポイント因子を同定し、がんや慢性感染症などの難治性疾病の発症の原因に免疫チェックポイント因子が関与していることを明らかにしてきました。さらには動物用の免疫チェックポイント阻害薬を開発し、実際の動物の患者に投与することによりその効果を検証してきました。本コラムでは北海道大学大学院獣医学研究院が取り組んできた動物の難治性疾病に対する創薬研究の中から、動物の免疫療法について紹介します。
2. 動物の難治性疾病における宿主免疫回避機序
慢性感染症や腫瘍疾患などの難治性疾病において、種々の免疫チェックポイント因子がその病態進行および維持に関連することが明らかとなり、感染細胞や腫瘍細胞を排除することができない免疫回避機序の一因であることが示されています。このような慢性感染症や腫瘍疾患ではPD-1 に代表される免疫チェックポイント因子が、エフェクター細胞(感染細胞や腫瘍細胞を排除するリンパ球などの免疫細胞)上で発現が上昇し、それぞれのリガンドと結合することでエフェクター細胞の免疫疲弊化を誘発し、細胞増殖能、サイトカイン産生能、細胞傷害機能などが著しく低下することが明らかとなっています(図1)。
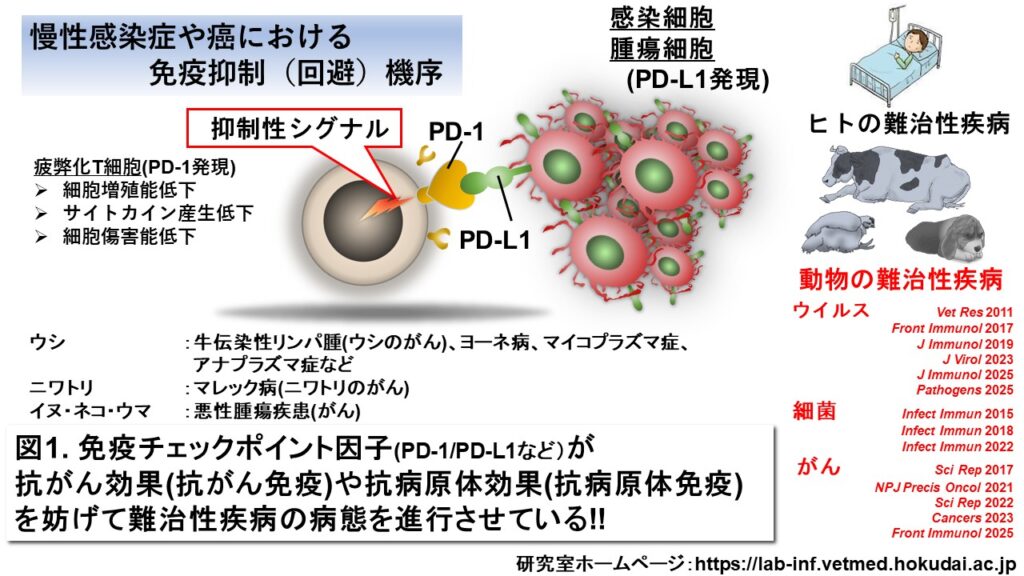
一方、この反応は可逆的であることから、抗体を用いてその機能を阻害する免疫学研究や臨床試験研究が活発に行われました。例えば、PD-1のシグナルを抑制する抗Programmed death-ligand 1(PD-L1)抗体や抗PD-1抗体を投与すると、病原体または腫瘍特異的T細胞の増殖能やサイトカイン産生能などのエフェクター機能が、見事に回復することが明らかとなりました。この知見が基盤となり、免疫を抑制する免疫チェックポイント因子の機能を阻害することにより、免疫疲弊に陥ったエフェクター細胞を再活性化するという免疫療法がヒトの悪性黒色腫に対する新規治療として2014年に最初に実用化に至りました(図2)。
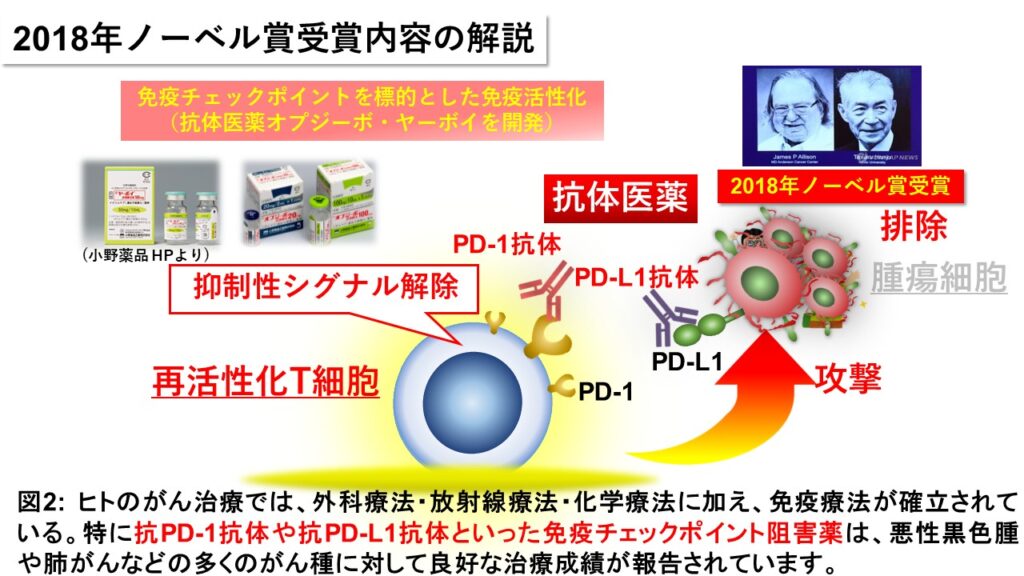
現在、抗PD-1抗体「オプジーボ」(ニボルマブ)に代表される免疫チェックポイント阻害薬が次々登場し、悪性黒色腫をはじめとした多くのがん種において著効を示しています。先述したとおり、本免疫療法の特徴の一つは、免疫チェックポイント因子による免疫抑制機序が同じであれば、異なる病原体や異なるがん種であっても一つの薬(免疫チェックポイント阻害薬)で横断的な治療が可能なところにあります。このことは、まだ多くの予防・治療法や疾病対策が確立されていない獣医療向きとも言えます。我々はこれまでに、腫瘍疾患や慢性感染症などを対象とした創薬研究を行い、それらの解析結果を基盤とした免疫療法による臨床研究を行ってきました。
コラム創薬研究
生殖細胞が持つポテンシャル -乾燥状態でも失われない受精能力-
大阪公立大学大学院獣医学研究科
金子 武人
はじめに
我々の研究室では、動物を中心とした受精メカニズムの解明、体外での受精技術の開発、細胞の長期保存法の開発、遺伝子改変動物の作製法の開発など生殖学に関連した多岐にわたる研究を行っています1。これまで、電気の力で細胞に穴をあけ遺伝子を細胞内に導入するエレクトロポレーション法を用いた遺伝子改変動物作製法(テイク法)の開発2-4、音波を用いて雌の妊娠環境を構築する方法(EGET)の開発5-7など、これまで用いられていた方法とは異なる新しい生殖技術の開発を行っています。
細胞の長期保存法の開発では、研究に用いられる動物の種や系統を生殖細胞である精子、卵子、そして受精卵の形で保存することで動物の利用を最小限にすることができます。精子、卵子、受精卵の保存で、最初に思い浮かべるのは液体窒素や冷凍庫で保存する凍結保存だと思います。ここでは、凍結保存とは異なる我々の研究室で開発したフリーズドライによる精子保存法について紹介したいと思います。
フリーズドライとは
「フリーズドライ」という言葉は聞いたことがあると思います。スーパーマーケットに行くとスープやコーヒーなどのラベルに書かれていることもあり、食品保存の分野ではよく用いられている技術です。フリーズドライは和訳すると凍結乾燥、つまり凍結してから乾燥させる技術です。水分を含んだサンプルを急速に凍結した後、真空状態にすることでサンプル中の水分を固体から気体へと昇華させながら乾燥状態にしていきます。フリーズドライ後のサンプルは、栄養成分や風味の劣化が少ないだけでなく、長期保存が可能になります。このことから、食品の保存だけでなく、医薬品の製造などにも利用されています。使用するときは、水を加えるだけで元の状態に戻すことができます。長期保存ができ、水分も少なく重量が軽くなるため非常食や携行食にも有効です。国際宇宙ステーションで活動する宇宙飛行士の食事(宇宙食)としても活用されています。フリーズドライ技術は、我々の生活のみならず、科学研究をも強力にサポートしているのです。
精子をフリーズドライ技術で保存する
このフリーズドライ技術を用いて精子を乾燥させたらどうなるでしょうか。一度乾燥してしまった精子は受精する能力を失ってしまったように見えます。ですが、哺乳動物の多くの精子は、フリーズドライしても受精能力は維持されています。マウス、ラット、ウサギ、ハムスター、ウマ、ウシの精子はフリーズドライ後も受精能力が維持され、これらの精子と受精した卵子から正常な産子が誕生することが報告されています8-9。
フリーズドライ保存は、凍結保存と何が違うのか。精子を凍結した場合は、保存するのに必ず液体窒素が必要になります。一方、フリーズドライした精子は、その保存に液体窒素は必要なく、冷蔵庫(4℃)での長期保存が可能です。「液体窒素不要の長期保存の実現」、これがフリーズドライ保存法の最大の利点です。そのほかにも、多くの利点があり表1に示してみました。
表1:フリーズドライ保存法と凍結保存法の比較
| フリーズドライ保存法 | 凍結保存法 | |
| 保存方法 | 冷蔵庫(4℃) | 液体窒素保管容器(液体窒素) |
| 保存液 | トリス-EDTAバッファー | 凍結保護物質 |
| 輸送方法 | 常温・簡易包装 | 液体窒素輸送器(ドライシッパー) |
| 緊急時保存可能期間* | 常温で3ヶ月 | 2週間程度 |
*液体窒素や電気などの供給が途絶した状況でサンプルを保存できる期間
液体窒素での凍結保存は、専用の液体窒素保管容器を用意し、さらに液体窒素は容器内で蒸発するため定期的に補充しなければなりません。液体窒素の補充は、重労働で酸欠を伴う危険な作業であるだけでなく、うっかり補充を忘れて液体窒素保管容器内の液体窒素を空にしてしまい、大事なサンプルを全滅させてしまったと言う話も聞きます。その点、冷蔵庫で長期保存できるフリーズドライ精子はそのような心配もなく、サンプルの国内外の施設間移動も容易にできます。実際に筆者は、日本-アメリカ間を簡易な包装で常温輸送したフリーズドライ精子から正常な産子の作出に成功しています10。これにより、生体で輸送することなく、簡易で安全に遺伝資源を移動させることが可能となりました。
震災や災害による貴重な研究生物試料の喪失
研究に用いられる生物試料は、様々な形で長期間保管されています。これらの中には、同じものを復元することが難しい貴重な試料も存在します。特に動物は、有効な形質を残す育種により長期間飼育されて現在に至っており、復元にも長い年月を要します。災害は、これまで蓄積してきた貴重な研究試料を一瞬で奪っていきます。近年は、気候変動により多くの地域で災害が起こっており、喪失の危険性は年々増加しているのが現状です。国内でも風水害による長期停電や浸水、地震による道路の寸断や建物崩壊が多くのところで起きています。液体窒素容器保管施設が地下に設置されている場合、大雨による浸水は致命的であり、地震により長期停電や液体窒素を補充できずに、ディープフリーザーや液体窒素保管容器で保存されていた貴重な研究試料の多くが失われたことも実際に国内外で報告されています。
筆者がフリーズドライ保存法の研究を始めた理由は、「インスタントコーヒーのように精子を保存しよう!」という知的好奇心でした。しかし、そのころ同時に大規模な自然災害が国内外で起きていたことから、その考えは安全な遺伝資源保存法としてフリーズドライ保存法を確立することに変わっていきました。表1に示した通り、フリーズドライ精子は冷蔵庫の電源が喪失しても3ヶ月程度は常温で保存できるため、試料さえ救出できれば簡易な梱包で安全な場所に移動させることが可能です。このことからも、フリーズドライ精子保存法は、これまでの液体窒素による凍結保存法と並行して、貴重な遺伝資源を安全に保存する上で極めて有効な方法であるといえます。
コラム実験動物
ちゃんと向き合いたい、
実験動物のこと。
実験動物というとどんなイメージがあるでしょうか。
動物を実験に活用することへの抵抗感をお持ちの方もいらっしゃるかもしれません。
しかし、実験動物に携わる関係者の間では実験動物を科学的合理性だけでなく、
動物福祉の観点からも向き合い、飼育環境の改善、実験方法や規制の見直しといった工夫を
日々行っております。
当団体では、そういった日々進化する実験動物に関する情報を
様々なコンテンツを通じて発信しております。
当サイトが、実験動物に関心のある方々の理解を促進し、
よりよい動物と人間の共存関係を実現する一助となれば幸いに存じます。

動物の難治性疾病に対する創薬研究 〜動物の免疫療法について〜
北海道大学大学院獣医学研究院
今内 覚
1. はじめに
近年、動物も衛生環境の改善、飼育環境や食事の改善から急速に長寿化が進んでいます。『家庭どうぶつ白書 2023』(https://www.anicom-page.com/hakusho/)によると、2021年度のイヌの平均寿命は14.2歳、ネコの平均寿命は14.7歳とのことです。2008年度の報告時では、イヌの平均寿命は13.2歳、ネコの平均寿命は13.9歳でしたので、イヌでは+1.0歳、ネコでは+0.8歳寿命が伸びたことになります。驚くことに、急速に延びたイヌのこの寿命の期間は、ヒトの約4歳以上に相当するそうです。
一方で、長寿命化に伴い悪性腫瘍(がん)によって命を落とす動物が増えており、既存の治療法(手術、抗がん剤療法、放射線療法)に加えて新たな治療戦略の開発が望まれています。ヒトの医療では、2014年に登場した抗Programmed death 1(PD-1)抗体「オプジーボ」(ニボルマブ)に代表される免疫チェックポイント阻害薬を用いた免疫療法が次々臨床応用され、悪性黒色腫をはじめとした多くのがん種において著効を示し、現在は免疫療法が第4の治療戦略として確立されています。本免疫療法の特徴の一つは、免疫チェックポイント因子によるがんに対する免疫の抑制機序が同じであれば、異なるがん種であっても同じアプローチ(同じ医薬品)で治療が横断的に可能なところにあります。ヒトの新たながん治療法として道を切り開いた免疫チェックポイント阻害薬開発者の京都大学・本庶 佑先生には、2018年にノーベル生理学・医学賞が授与されています。
我々の研究グループはこれまでに、様々な動物の免疫チェックポイント因子を同定し、がんや慢性感染症などの難治性疾病の発症の原因に免疫チェックポイント因子が関与していることを明らかにしてきました。さらには動物用の免疫チェックポイント阻害薬を開発し、実際の動物の患者に投与することによりその効果を検証してきました。本コラムでは北海道大学大学院獣医学研究院が取り組んできた動物の難治性疾病に対する創薬研究の中から、動物の免疫療法について紹介します。
2. 動物の難治性疾病における宿主免疫回避機序
慢性感染症や腫瘍疾患などの難治性疾病において、種々の免疫チェックポイント因子がその病態進行および維持に関連することが明らかとなり、感染細胞や腫瘍細胞を排除することができない免疫回避機序の一因であることが示されています。このような慢性感染症や腫瘍疾患ではPD-1 に代表される免疫チェックポイント因子が、エフェクター細胞(感染細胞や腫瘍細胞を排除するリンパ球などの免疫細胞)上で発現が上昇し、それぞれのリガンドと結合することでエフェクター細胞の免疫疲弊化を誘発し、細胞増殖能、サイトカイン産生能、細胞傷害機能などが著しく低下することが明らかとなっています(図1)。

一方、この反応は可逆的であることから、抗体を用いてその機能を阻害する免疫学研究や臨床試験研究が活発に行われました。例えば、PD-1のシグナルを抑制する抗Programmed death-ligand 1(PD-L1)抗体や抗PD-1抗体を投与すると、病原体または腫瘍特異的T細胞の増殖能やサイトカイン産生能などのエフェクター機能が、見事に回復することが明らかとなりました。この知見が基盤となり、免疫を抑制する免疫チェックポイント因子の機能を阻害することにより、免疫疲弊に陥ったエフェクター細胞を再活性化するという免疫療法がヒトの悪性黒色腫に対する新規治療として2014年に最初に実用化に至りました(図2)。

現在、抗PD-1抗体「オプジーボ」(ニボルマブ)に代表される免疫チェックポイント阻害薬が次々登場し、悪性黒色腫をはじめとした多くのがん種において著効を示しています。先述したとおり、本免疫療法の特徴の一つは、免疫チェックポイント因子による免疫抑制機序が同じであれば、異なる病原体や異なるがん種であっても一つの薬(免疫チェックポイント阻害薬)で横断的な治療が可能なところにあります。このことは、まだ多くの予防・治療法や疾病対策が確立されていない獣医療向きとも言えます。我々はこれまでに、腫瘍疾患や慢性感染症などを対象とした創薬研究を行い、それらの解析結果を基盤とした免疫療法による臨床研究を行ってきました。
コラム創薬研究

生殖細胞が持つポテンシャル -乾燥状態でも失われない受精能力-
大阪公立大学大学院獣医学研究科
金子 武人
はじめに
我々の研究室では、動物を中心とした受精メカニズムの解明、体外での受精技術の開発、細胞の長期保存法の開発、遺伝子改変動物の作製法の開発など生殖学に関連した多岐にわたる研究を行っています1。これまで、電気の力で細胞に穴をあけ遺伝子を細胞内に導入するエレクトロポレーション法を用いた遺伝子改変動物作製法(テイク法)の開発2-4、音波を用いて雌の妊娠環境を構築する方法(EGET)の開発5-7など、これまで用いられていた方法とは異なる新しい生殖技術の開発を行っています。
細胞の長期保存法の開発では、研究に用いられる動物の種や系統を生殖細胞である精子、卵子、そして受精卵の形で保存することで動物の利用を最小限にすることができます。精子、卵子、受精卵の保存で、最初に思い浮かべるのは液体窒素や冷凍庫で保存する凍結保存だと思います。ここでは、凍結保存とは異なる我々の研究室で開発したフリーズドライによる精子保存法について紹介したいと思います。
フリーズドライとは
「フリーズドライ」という言葉は聞いたことがあると思います。スーパーマーケットに行くとスープやコーヒーなどのラベルに書かれていることもあり、食品保存の分野ではよく用いられている技術です。フリーズドライは和訳すると凍結乾燥、つまり凍結してから乾燥させる技術です。水分を含んだサンプルを急速に凍結した後、真空状態にすることでサンプル中の水分を固体から気体へと昇華させながら乾燥状態にしていきます。フリーズドライ後のサンプルは、栄養成分や風味の劣化が少ないだけでなく、長期保存が可能になります。このことから、食品の保存だけでなく、医薬品の製造などにも利用されています。使用するときは、水を加えるだけで元の状態に戻すことができます。長期保存ができ、水分も少なく重量が軽くなるため非常食や携行食にも有効です。国際宇宙ステーションで活動する宇宙飛行士の食事(宇宙食)としても活用されています。フリーズドライ技術は、我々の生活のみならず、科学研究をも強力にサポートしているのです。
精子をフリーズドライ技術で保存する
このフリーズドライ技術を用いて精子を乾燥させたらどうなるでしょうか。一度乾燥してしまった精子は受精する能力を失ってしまったように見えます。ですが、哺乳動物の多くの精子は、フリーズドライしても受精能力は維持されています。マウス、ラット、ウサギ、ハムスター、ウマ、ウシの精子はフリーズドライ後も受精能力が維持され、これらの精子と受精した卵子から正常な産子が誕生することが報告されています8-9。
フリーズドライ保存は、凍結保存と何が違うのか。精子を凍結した場合は、保存するのに必ず液体窒素が必要になります。一方、フリーズドライした精子は、その保存に液体窒素は必要なく、冷蔵庫(4℃)での長期保存が可能です。「液体窒素不要の長期保存の実現」、これがフリーズドライ保存法の最大の利点です。そのほかにも、多くの利点があり表1に示してみました。
表1:フリーズドライ保存法と凍結保存法の比較
| フリーズドライ保存法 | 凍結保存法 | |
| 保存方法 | 冷蔵庫(4℃) | 液体窒素保管容器(液体窒素) |
| 保存液 | トリス-EDTAバッファー | 凍結保護物質 |
| 輸送方法 | 常温・簡易包装 | 液体窒素輸送器(ドライシッパー) |
| 緊急時保存可能期間* | 常温で3ヶ月 | 2週間程度 |
*液体窒素や電気などの供給が途絶した状況でサンプルを保存できる期間
液体窒素での凍結保存は、専用の液体窒素保管容器を用意し、さらに液体窒素は容器内で蒸発するため定期的に補充しなければなりません。液体窒素の補充は、重労働で酸欠を伴う危険な作業であるだけでなく、うっかり補充を忘れて液体窒素保管容器内の液体窒素を空にしてしまい、大事なサンプルを全滅させてしまったと言う話も聞きます。その点、冷蔵庫で長期保存できるフリーズドライ精子はそのような心配もなく、サンプルの国内外の施設間移動も容易にできます。実際に筆者は、日本-アメリカ間を簡易な包装で常温輸送したフリーズドライ精子から正常な産子の作出に成功しています10。これにより、生体で輸送することなく、簡易で安全に遺伝資源を移動させることが可能となりました。
震災や災害による貴重な研究生物試料の喪失
研究に用いられる生物試料は、様々な形で長期間保管されています。これらの中には、同じものを復元することが難しい貴重な試料も存在します。特に動物は、有効な形質を残す育種により長期間飼育されて現在に至っており、復元にも長い年月を要します。災害は、これまで蓄積してきた貴重な研究試料を一瞬で奪っていきます。近年は、気候変動により多くの地域で災害が起こっており、喪失の危険性は年々増加しているのが現状です。国内でも風水害による長期停電や浸水、地震による道路の寸断や建物崩壊が多くのところで起きています。液体窒素容器保管施設が地下に設置されている場合、大雨による浸水は致命的であり、地震により長期停電や液体窒素を補充できずに、ディープフリーザーや液体窒素保管容器で保存されていた貴重な研究試料の多くが失われたことも実際に国内外で報告されています。
筆者がフリーズドライ保存法の研究を始めた理由は、「インスタントコーヒーのように精子を保存しよう!」という知的好奇心でした。しかし、そのころ同時に大規模な自然災害が国内外で起きていたことから、その考えは安全な遺伝資源保存法としてフリーズドライ保存法を確立することに変わっていきました。表1に示した通り、フリーズドライ精子は冷蔵庫の電源が喪失しても3ヶ月程度は常温で保存できるため、試料さえ救出できれば簡易な梱包で安全な場所に移動させることが可能です。このことからも、フリーズドライ精子保存法は、これまでの液体窒素による凍結保存法と並行して、貴重な遺伝資源を安全に保存する上で極めて有効な方法であるといえます。
コラム実験動物








