理研マウスENUミュータジェネシスプロジェクトを利用したフォワードジェネティクス研究
2. トーランス型扁平異形成症モデル : M413/M856マウス
次に紹介するM413とM856マウスは共に常染色体顕性形式で体が小型化 (矮小化) するマウスです7)8)。連鎖解析によって原因遺伝子は共に第15染色体上にマップされたことから、両マウスの原因遺伝子は同一の可能性があると思われました。この領域に存在する遺伝子を調べた結果、軟骨で特異的に産生される II型コラーゲンをコードするCol2a1が原因遺伝子の第一候補として選抜され、確かにM413マウスのCol2a1遺伝子にはp.Try1391Ser、M856マウスにはp.Asp1499Alaミスセンス変異が同定されました。
ヒトにおけるCOL2A1変異は、軟骨無発生症II型、トーランス型扁平異形成症(PLSD-T)、先天性脊椎骨端異形成症といった別々の病気の原因となりますが9) 、PLSD-T患者にp. Try1391Cys、p. Asp1469His変異が同定されていました。すなわち、II型コラーゲンの1391番目のCys、1469番目のAspが、M413またはM856マウスとPLSD-T患者で共に置換されている訳です。それぞれの変異のホモ接合マウスはPLSD-Tと類似の骨格異常を示しており、M413/M856ホモ接合マウスはPLSD-Tモデル動物として有用性であることが示されました。M413とM856マウスの間に表現型の違いはみつかっていませんが、別々の論文として発表することができました7)8) 。
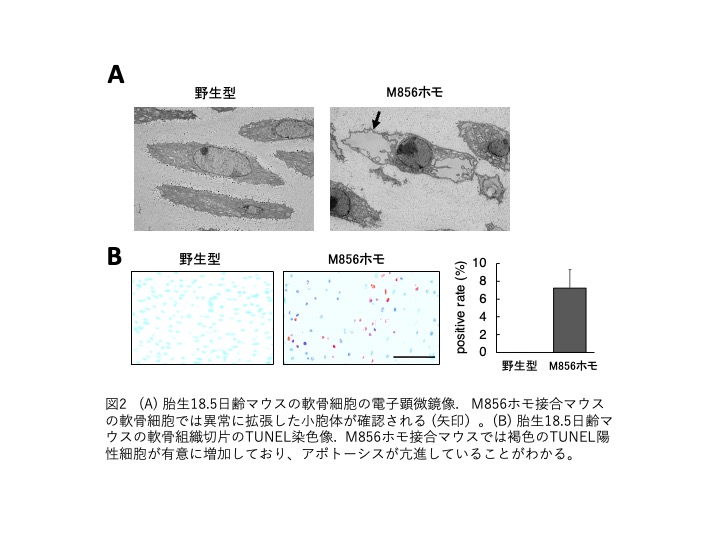
両マウスの軟骨細胞を電子顕微鏡で観察すると、小胞体が異常に拡張しており、変異コラーゲンタンパク質が小胞体内に貯留していました(図2A)。軟骨における小胞体ストレスマーカーの発現が上昇しており、軟骨細胞は高頻度にアポトーシスを起こしていました(図2B)。つまり、M413/M856ホモ接合マウスの軟骨細胞では異常タンパク質の貯留により過度の小胞体ストレスが付加され、アポトーシスが亢進していることがわかりました。PLSD-Tの第一の原因はII型コラーゲンが細胞外へ分泌されないことですが、軟骨細胞におけるアポトーシスの亢進も大きく関わっているようです。
最近、さまざまな疾患と小胞体ストレスとの関連が注文されており、小胞体ストレス応答調節薬の創薬研究が展開されています10)。M413/M856マウスは小胞体ストレス応答調節薬の創薬研究に有用なモデル動物ですと締めたいとこですが、応用は難しいと思っています。PLSD-Tは周産期致死性の重度の骨格異常を示し、PLSD-TモデルとなるM413/M856ホモ接合マウスは出生後、すぐに死亡してしまいます。このような致死性の骨格異常を薬で直すのは、現時点では不可能であると思います。しかし、小胞体ストレスが関わっている軽度の骨格異常を示す疾患は存在しており、これらの疾患を対象とした小胞体ストレス応答調節薬の創薬研究に、M413/M856マウスから調整した培養軟骨細胞などが貢献できるかもしれません。

 JALAM教育委員会
JALAM教育委員会