非アルコール性脂肪性肝疾患のモデルマウス

糖質を増加させることもNAFLD/NASHの発症や進行に影響を与えます。特に過剰なフルクトースはマウスの肝臓に深刻な障害をもたらします[3]。腸管で吸収されたフルクトースは殆どが肝臓で取り込まれアセチルCoAに変換されます。合成されたアセチルCoAはクエン酸回路を介してATP合成に使用されますが、余剰分については脂質合成に用いられることで脂肪肝の原因となります[5]。また腸管においては、フルクトースは腸内細菌叢の異常な増殖を促すことで、門脈を通じて肝臓に流入するバクテリア由来のエンドトキシン量を増やします[3]。結果的にクッパー細胞をはじめとした肝臓内の免疫細胞が活性化され、肝炎の原因となると考えられています。初期の研究でフルクトースとグルコース(以上単糖類)、ショ糖(二糖類)を自由給餌させたマウスではフルクトースが最も肝臓への傷害が大きいことが示されましたが、その後の研究で、フルクトース単独給餌よりグルコースとの混合液の方が腸でのフルクトースの取り込みが促進され、障害が大きくなるという知見もあります[5]。
肝臓は中性脂肪をVLDL(超低密度リポタンパク質)の形で血液中に放出します。VLDLの放出にはVLDLを構成する主要リン脂質であるホスファチジルコリンが必須であることから、その材料となるメチオニンやコリンは肝臓からの脂質の排泄に不可欠といえます。そこでメチオニンやコリンを欠損させた餌(MCD)を与えることで肝臓に脂質を滞留させることも、NAFLD/NASHを誘導させるために古くから使用される手法です[10]。この方法の欠点は、メチオニンの欠損が肝臓以外の部位にも悪影響を与えることです[16]。事実、MCD給餌マウスでは、顕著な筋重量の減少が知られています。従って純粋に肝臓の異常に起因する変化を解析したいときには不向きなモデルといえます。
一方、コリン欠乏L-アミノ酸添加飼料(CDAA)モデルもNAFLD/NASHの誘導に広く用いられます。この動物モデルでも、脂肪肝、肝細胞傷害、肝線維化、さらに肝がんの発症が認められますが、体重や肝重量、インスリン感受性などは通常飼育下のマウスと大差ないので、ヒトのNAFLD/NASH病態とは異なる部分があると考えられます[14]。このモデルはラットでは劇的な肝障害をもたらしますが、マウスでは障害作用が限定的であり、実験個体によっては全く障害がみられないこともあることから[16]、個体数削減を考えるうえでは推奨できません。
このように食餌性NAFLD/NASH誘導モデルには様々な長所・短所が知られていますが、時間をかければ高脂肪餌給餌によって、最終的にマウスに高い確率で肝障害をもたらします。中外製薬の松本らは、この点に着眼しました。彼らはCDAAと高脂肪餌を組み合わせた、コリン欠乏0.1%メチオニン添加高脂肪飼料(CDAHFD)によるNASH誘導モデルを考案しました[13]。CDAHFDを3週間給餌したC57BL/6マウスはCDAA給餌マウスモデルと異なり明らかな肝肥大が認められました[13] (図1)。このモデルでは給餌開始1週間後より脂肪肝の組織像が認められ、血中ALT値が増加します[13]。さらに給餌6週目には高率に肝線維化が認められます[13]。このようなことから、CDAHFDは現在、広くNAFLD/NASH誘導モデルに使用されています。
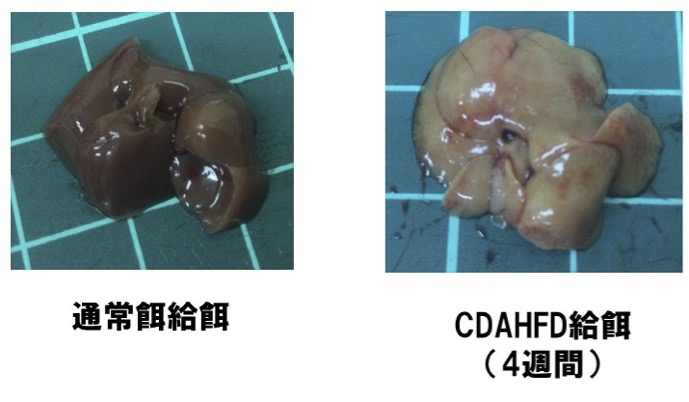
図1.通常餌またはCDAHFDを4週間給餌したマウスの肝臓の肉眼所見
CDAHFD(コリン欠乏0.1%メチオニン添加高脂肪飼料、本文参照)を給餌したマウスの肝臓は脂肪肝に伴う臓器色の変化と腫大が認められる。

 JALAM教育委員会
JALAM教育委員会