生殖細胞が持つポテンシャル -乾燥状態でも失われない受精能力-
コラム 実験動物
精子をフリーズドライする方法
では、ここからはフリーズドライ精子の作製から産子作出までの方法について具体的に解説していきます。まず、フリーズドライ精子の作製はどのように行うのか。その方法は意外と簡単です。生体から採取した精子は、トリス-EDTAバッファーと呼ばれる溶液に混ぜます。その後ガラスアンプルに充填し、凍結乾燥機で乾燥させるだけで完成します(図1)10。トリス-EDTAバッファーは、分子生物学研究で一般的に用いられている溶液で細胞から抽出したDNAを長期に保存することができる溶液です。精子がフリーズドライ保存できることが分かった当初は、細胞の培養に使用する溶液を用いてフリーズドライされていました。しかし、この方法では保存期間が長くなるにつれて、精子がダメージを受けてしまうことが分かりました。そこで、どうしたら精子がダメージを受けずに受精能力を持ち続けるか検討が始まります。精子が卵子と受精するには、まず精子が卵子表面に到達するための運動性が必要になります。しかし、運動性は受精後の胚の発生には関係なく、最終的に産子が誕生するためには、精子の中のDNAが正常でなければならないということに行き着きました。その結果、精子のDNAをフリーズドライした後も正常に維持する溶液を長年検討する中でトリス-EDTAバッファーの利用を思いつきました。そして、実際にこの溶液を用いて精子をフリーズドライしたところ、高い受精能力を維持できることが明らかとなりました10。さらに、精子DNAを分解する酵素は、温度上昇により活性を高めることが分かったため、フリーズドライ精子を4℃で保存したところ、分解酵素の活性を抑制することができ長期間保存することに成功しました。細胞を保存するためには、細胞を破壊するあらゆる要素から守るために多くの試薬や細胞保護物質を混ぜた溶液を作らないといけないと思っていましたが、たった2種類の試薬を含むトリス-EDTAバッファーで精子のDNAが保存できてしまったことは驚きでした。このように、精子DNAを保護してフリーズドライすることに成功しましたが、現在のフリーズドライ法では運動性を維持することができないため、水で戻した精子は、その形はきれいに維持しているものの運動性は復活できないというのが現状です。
動かないフリーズドライ精子から産子は得られるのか?
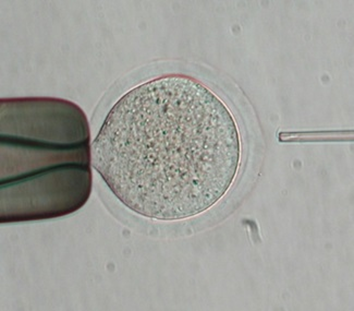
精子を卵子と受精させるには、人工受精や体外受精が用いられます。この方法は精子に運動性がないと成立しない技術であるため、水に戻した後動かないフリーズドライ精子にこの受精方法は使えません。では、どのようにフリーズドライ精子を卵子と受精させるのか。その方法は顕微授精です。顕微授精は、微細なガラス管に精子を吸引し、そのガラス管を卵子内に挿入することで受精させる技術であり、別名ICSI(Intracytoplasmic Sperm Injection;イクシー)と呼ばれる動物だけでなくヒトの不妊症治療の主力技術として利用されている技術です(図2)。ICSIは、受精の概念を大きく変えた技術であり、これまで動かない精子や運動性が極端に低い精子は受精できない精子として認識されていたのが、ICSIにより産子が誕生したことで動かない精子でも受精能力を維持していることが証明されました。さらに、ICSIを用いることで形成過程の未熟な精子からも産子を誕生させることができるようになり、体外での受精技術は革新的に進化しました。現在、多くの動物種でフリーズドライ精子から産子が得られているのも、ICSIの技術開発が大きく影響しています。
我々はこれまで、冷蔵庫で3~5年間保存したマウス・ラットのフリーズドライ精子から産子を誕生させることに成功しており、フリーズドライ精子保存法は遺伝資源を保存する技術として十分活用することができます11-12。また、マウス・ラット以外にも上述した多くの動物で成功例が報告されていることから、今後ますます利用が多くなることが予想されます。

精子はアンプルの底に粉状になる

卵子や受精卵はフリーズドライ保存できるの?
ここまで、精子のフリーズドライ保存法の実際についてご紹介してきましたが、卵子や受精卵はフリーズドライ保存できるのか疑問に思う方もいらっしゃると思います。現時点では、卵子や受精卵のフリーズドライ保存に成功したという報告はありません。卵子や受精卵は他の細胞と比べて非常に大きな細胞であるため、フリーズドライ保存が難しく成功に至っていませんが、今後の科学の進歩が期待されます。さらに、フリーズドライ精子も現在運動性を維持できていませんが、将来運動性を持つフリーズドライ精子が作製できるようになれば、顕微授精が難しい施設や動物種でも人工授精や体外受精を使って産子を誕生させられるようになるかもしれません。
最後に
フリーズドライ精子保存法は現在、動物において実用化レベルにまで開発することができていますが、まだ改良しなければならない課題もあります。しかし、これまで多くの動物種で成功例が報告されており、筆者らも精子フリーズドライ保存法の活躍の場を広げるために、この方法を絶滅危惧種の保全に応用しています13。これまでに約70種の野生動物の精子を保存しており、この中にはヤンバルクイナ、オオワシ、オジロワシ、ツシマヤマネコ、アマミノクロウサギといった国内の絶滅危惧種も含まれています。我々が開発した技術が動物を絶滅から守ることにつながってほしいと思います。
今回のコラムで、生物、細胞が持つポテンシャルを知り、少しでも興味を持っていただければ幸いです。詳しい研究内容は当研究室のHPをご覧ください1。
参考文献
1. 大阪公立大学大学院獣医学研究科実験動物学教室 https://www.omu.ac.jp/vet/las
2. Kaneko T, Sakuma T, Yamamoto T, Mashimo T. Simple knockout by electroporation of engineered endonucleases into intact rat embryos. Sci Rep. 4: 6382, 2014. doi: 10.1038/srep06382.
3. Kaneko T, Mashimo T. Simple Genome Editing of Rodent Intact Embryos by Electroporation. PLoS One. 10: e0142755, 2015. doi: 10.1371/journal.pone.0142755.
4. Kaneko T.Genome Editing in Mouse and Rat by Electroporation. Methods Mol Biol. 2637: 125-134, 2023. doi: 10.1007/978-1-0716-3016-7_10.
5. Kaneko T, Endo M, Tsunoda S, Nakagawa Y, Abe H. Simple induction of pseudopregnancy by artificial stimulation using a sonic vibration in rats. Sci Rep. 10: 2729, 2020. doi: 10.1038/s41598-020-59611-1.
6. Endo M, Tsunoda S, Tawara H, Abe H, Kaneko T. Successful pseudopregnancy of rats by short period artificial stimulation using sonic vibration. Sci Rep. 12: 1187, 2022. doi: 10.1038/s41598-022-05293-w.
7. Wake Y, Endo M, Tsunoda S, Tawara H, Abe H, Nakagawa Y, Kaneko T.Successful induction of pseudopregnancy using sonic vibration in mice. Sci Rep. 13: 3604, 2023. doi: 10.1038/s41598-023-30774-x.
8. Kaneko T. Simple gamete preservation and artificial reproduction of mammals using micro-insemination techniques. Reprod Med Biol. 14, 99-105, 2015. doi: 10.1007/s12522-014-0202-4.
9. Kaneko T. Sperm freeze-drying and micro-insemination for biobanking and maintenance of genetic diversity in mammals. Reprod Fertil Dev. 28, 1079-1087, 2016. doi: 10.1071/RD15386.
10. Kaneko T. Simple sperm preservation by freeze-drying for conserving animal strains. Methods Mol Biol. 1239, 317-329, 2015. doi: 10.1007/978-1-4939-1862-1_19.
11. Kaneko T, Serikawa T. Long-term preservation of freeze-dried mouse spermatozoa. Cryobiology 64, 211-214, 2012. doi: 10.1016/j.cryobiol.2012.01.010.
12. Kaneko T, Serikawa T. Successful long-term preservation of rat sperm by freeze-drying. PLoS One 7, e35043, 2012. doi: 10.1371/journal.pone.0035043.
13. Kaneko T, Ito H, Sakamoto H, Onuma M, Inoue-Murayama M. Sperm preservation by freeze-drying for the conservation of wild animals. PLOS ONE. 9, e113381, 2014. doi: 10.1371/journal.pone.0113381.
関連記事

動物福祉の評価ツールのご紹介-1
〜AVMA主催の“学生動物福祉状況の評価コンテスト”〜
さて、イリノイ大のニュースによると、このコンテストの目的は、「農業、研究、伴侶など、人間のために使用される動物に影響を与える福祉問題の理解と認識を高めるための教育ツールを経験することであり、倫理的推論に対する理解の上に、科学的理論とデータに基づいた動物福祉の客観的評価を促し、批判的思考を促進し、コミュニケーション能力を向上させる」ことです。参加対象は、3・4年学部生、獣医学部生、院生(1チーム3-5人)であり、動物看護師やAVMA会員の獣医師も少数に限り参加できます(ただし、コンテストの対象外)。参加者はいくつかのシナリオに沿って出題される動物とその福祉状況を分析して、その中から優れたシナリオを選び出し、発表するというものです。
ニュースでは、“動物福祉のさまざまな事象をそのときどきの断片として客観的かつ定量的に評価することも可能ですが、福祉問題は連続したものであり、どのあたりで許容できるか、どのあたりが好ましいか、または許容できないかの判断は、多くの場合、倫理に基づく選択に帰着するものです。コンテストでは、問題解決へ学際的にアプローチするため、科学に基づく知識を倫理的価値観と統合することを学生に教えています”という風に審査の方法について説明しています。私たちが学生の動物福祉評価を審査するのであれば、北米でどのような基準やチェック方法に従って動物福祉が評価されているのかの具体例を知りたいところです。
今回はこのくらいにさせていただいて、次は、動物福祉評価のツールについて整理していきたいと思います。
参考文献
1) Beaver B. V. and Bayne K, Chapter 4 – Animal Welfare Assessment Considerations, Laboratory Animal Welfare, 29-38 (2014)
2) Animal welfare judging team provides unique experiential learning for students. (cited 2022. Oct.28)
3) AVMA Animal Welfare Assessment Contest. (cited 2022. Dec. 05)

動物福祉の評価ツールのご紹介-2
〜福祉を評価するツールを紹介するサイト1:USDAのNational Agricultural Library〜
Welfare Assessment Training and Resources(動物福祉の評価のトレーニングとリソース)
1)”CCAC Guidelines: Animal Welfare Assessment“
カナダ動物愛護協議会(CCAC, Canadian Council on Animal Care)が2021年に作成したガイドラインへのリンクです。このガイドは、なぜ福祉を評価するのか、福祉指標を特定し、福祉評価の文書化について説明しています。このガイドラインの要点を、極端に短くまとめれば、以下の5点に集約できます。
・評価の監督は委員会が担うが、評価そのものは評価実施者に任せる
・動物は健康であるべき
・福祉評価は定期的に実施する
・評価に用いた情報は研究者などが利用できるよう記録する
・評価の結果を動物実験委員会は利用する
2)“Welfare Assessment”
“動物実験の3Rsの推進”を図る、英国NC3Rs(The National Centre for the Replacement, Refinement & Reduction of Animals in Research)が作成した“Welfare Assessment”ガイドにリンクしています。このガイドでは、以下の情報を提供しています。
・福祉指標の特定
・実際上の侵襲性の評価と報告
・効果的な記録の保持とレビュー
・スタッフのトレーニング
・関連リソース
3)“Guide to Welfare Assessment Protocols”
苦痛の軽減(Refinement)に関する英国合同ワーキンググループ(JWGR)が2011年、Laboratory Animals誌に発表した“A guide to defining and implementing protocols for the welfare assessment of laboratory animals: eleventh report of the BVAAWF/FRAME/RSPCA/UFAW Joint Working Group on Refinement” へのリンクです。このガイドには、動物の苦痛の軽減に関する事項がかなり細かく記載されています。
・効果的な福祉評価スキームのための一般原則
・チームアプローチ
・良好な福祉の定義
・適切な福祉指標の選択
・動物福祉指標の記録システム
・評価のタイミング・期間・頻度
・実践的な福祉評価(観察・潜在的な福祉問題の指摘)
・福祉記録の確認
・倫理・動物愛護委員会との連携
・さらなる情報へのアクセス

 大阪公立大学大学院獣医学研究科 金子武人
大阪公立大学大学院獣医学研究科 金子武人 






