実験動物のケージサイズ
コラム 動物実験

と言うのも、実験動物の分野では動物福祉を念頭に入れながら飼育することはもちろんですが、多くの科学者たちが協力し、科学的根拠に基づいてケージサイズを決定してきた背景があります。現在、米国をはじめ世界中の多くの国で採用されているイヌのILAR (Institute for Laboratory Animal Research)の基準(ILAR Guide)、そしてまだ採り入れている国は少ないものの動物福祉に先進的なEUの基準(ETS 123)は以下のとおりです。
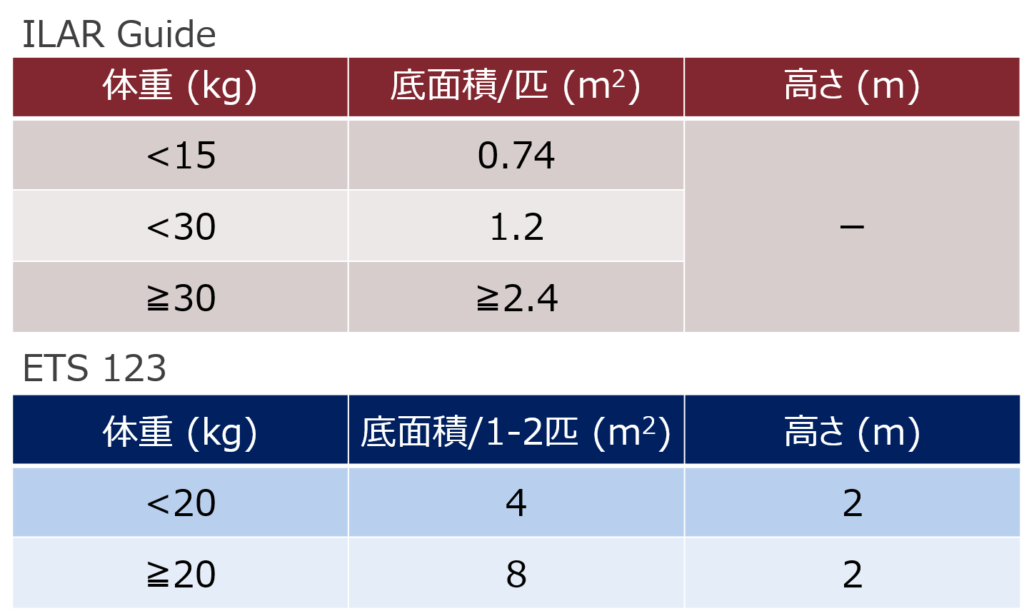
ILAR Guideは多くの改訂を経て、2011年に発行された第8版が最新のものになっています。この第8版を発行する際にはケージのサイズが大きく変更されましたが、研究者とブリーダーなどの業界団体との交渉が盛んになされた結果、こちらで落ち着いたと伺っています。その理由としてEUのように動物福祉を推進することはもっともですが、それによって実験動物が飼育できなくなり、結果的に研究の進捗が妨げられる事態は避けなければならないからです。そう言った意味で、ILARの基準は動物行動学などの科学的根拠と動物福祉の折り合いがついた結果だと考えられているため、多くの国で採用されているのだと私自身は考えています。
こういった科学的根拠なしに、かつ、業界との落としどころを見つけることなく様々な基準を決定すると、表に出てこない部分での飼育が広がる恐れがあり、結果として不幸な動物が増えてしまうのではないかと懸念しています。環境省の基準案は検討会に環境大臣が出席するほどの力の入れようですので、覆ることは恐らくないとみています。今回、このように舵を切ってしまったわけですから経過措置の期間やケージや施設の改作に関する補助など様々なサポートに関して今後議論して頂きたいと思います。
翻って我々の業界もILARサイズに収まっていればそこで飼い続けても良いのかといった問題はあるため、今回の環境省の基準案にある分離型の考えにある、定期的な運動は必要でしょうし、ゆくゆくはEUの基準での飼育が求められるものだと考えています。しかしそれには飼養数の減少が必要ですし、そのためにはイヌでの実験に代わる代替法の開発が急務であると考えています。
関連記事

ARRIVEガイドライン2.0が公開されました
7月14日にNC3Rs(英国3Rセンター)にてARRIVEガイドライン2.0が公開(https://arriveguidelines.org/)されました。2010年に初めて公開されたARRIVEガイドラインは、動物実験計画において最低限記載すべき項目をまとめたものであり、Natureをはじめ多くの学術雑誌に支持されているガイドラインです。
そもそもこのガイドラインが作成された背景には、動物実験の再現性があまりにも低い(一説には70%以上の実験が再現できない)と言われてきたことがあります。その一因として実験方法の詳細が述べられていないとの指摘がありました。
英国の機関が、動物実験の記載がある271報(1999-2005)の論文を精査したところ、研究の仮説・目的を記載し、かつ動物の数と特徴が記載されていたのは271報のうち、わずか59%であったことを報告(https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0007824)しています。
これらの事を受けてNC3Rsは記載すべき20の項目を定めて2010年にARRIVEガイドラインとして発表しました。多くの研究機関や出版社から支持されてきたものの、記載項目が多いことからも問題の根本的な解決には至りませんでした。そこで改訂版であるARRIVEガイドライン2.0が新たに公開されました。
ARRIVEガイドライン2.0の主な変更点は以下のとおりです。
記載すべき最低限の項目を10項目に絞った「ARRIVE Essential 10」とそれらを補完する「Recommended Set」に分類した
ARRIVE Essential 10は以下のとおりです。なお正式な日本語訳は日本実験動物学会等、公的機関によるアナウンスをお待ちください。
1. Study design(研究計画)
2. Sample size(サンプルサイズ)
3. Inclusion and exclusion criteria(包含基準と除外基準)
4. Randomisation(ランダム化)
5. Blinding(盲検化)
6. Outcome measures(実験の帰結)
7. Statistical methods(統計学的方法)
8. Experimental animals(実験動物の情報)
9. Experimental procedures(実験処置)
10. Results(結果)
前回のガイドラインが20項目であったことからも項目数を絞って記載しやすくなっていることが分かります。通常の動物実験審査においては3~5の項目を審査することは少ないのですが、今後はこのあたりも審査することが求められてくるかもしれません。

 JALAM学術集会委員会
JALAM学術集会委員会