マウスバイオリソースの源流 ~ラスロップ、リトルそしてジャクソン研究所

本ホームページに「マウスの系統間、亜系統間にみられる遺伝子型、表現型の違い〜C57BL/6JとC57BL/6Nとの比較を中心に」というコラムが登載されています。その中に、「C57BL/6は、C. C. リトルがA. E. ラスロップから1921年に入手したマウスから樹立したC57BL系統に由来します。C57BL/6系統は、1948年にアメリカのジャクソン研究所に導入され維持されてきました」という記載があります。リトルとジャクソン研究所については、実験動物に関わっている方や実験動物学の講義を受講した経験のある方なら一度は耳にしたことがあると思いますが、ラスロップについてはあまり馴染みの無い読者がいるかも知れません。今回は、ラスロップとリトル、リトルとジャクソン研究所の関係についてお話させていただきます。
関連記事

動物福祉の評価ツールのご紹介-1
〜AVMA主催の“学生動物福祉状況の評価コンテスト”〜
動物の福祉状況を良くしていこうと言われていますが、日本では、法律、指針や、日本学術会議のガイドラインにおいて、動物の福祉状況に関する評価方法の、簡便で使いやすい具体的な記述・指標は見当たりません。特に動物実験においては、法規制が求めるところが機関管理なので、具体的な記述や指標を設定することにむずかしいところがあることも理解ができますが、動物実験を管理し施行状況の評価を任される立場の視点から見ると、もう少し情報が欲しいところです。
実験動物の福祉状況の評価について世界に目を向けると、2014年にTexas A&M UniversityのBonnie V. BeaverとAAALAC InternationalのKathryn Bayneが、“Animal Welfare Assessment Considerations”1)という記事で評価法を公開しています。本コラムでは、数回にわたって、この視点から少し深堀りしてみましょう。
まず触れたいのは、“北米で、学生を対象とした動物福祉状況の評価コンテストが行われる”ことを紹介したイリノイ大学のニュース2)です。学生だけでなく、私たち実験動物医学の専門家の能力向上にも役立つのではないかと思い、紹介することにしてみました。
AVMAが学生対象に動物福祉評価コンテストを開催
イリノイ大学のニュースが詳しく紹介していたのは、AVMA(American Veterinary Medical Association)が先月(2022年11月)に開催した、“学生を対象とした動物福祉評価コンテスト:ANIMAL WELFARE ASSESSMENT CONTEST” 3)(下図は、その登録募集のチラシのコピー)についてです。本コンテストは、もともとミシガン州立大学(MSU)とパデュー大学の教員が提案し、2002年にMSU、ゲルフ大学、ウィスコンシン大学、パデュー大学の代表4チームが集まって始めた小さなコンテストから始まりました。これが、2014年には、北米各地の学校から合計28チーム、116名の参加者を集めるようになり、いまの形になったとのことです。当初は対象動物を家畜としていましたが、現在では、生産動物、コンパニオンアニマル、実験動物、エキゾチックアニマルにまで拡大しています。今年(2022年)の動物種には、展示用に飼育された鶏(愛玩用)、乳用牛(主に搾乳群に入らないオス)、水族館のタコが含まれます。仮想のしなりを設定は、アニマルシェルターの犬・猫です。参加者は、輸送、住居、健康、トレーニング、退役 、生産、屠殺/安楽死など、各動物種の生活のすべての側面における福祉を評価することになっています。頭足類を評価の対象に入れるところは、AVMAが時代の趨勢を敏感に反映していこうとする姿勢がうかがえます。このような先取の精神には見習う点があります。


動物福祉の評価ツールのご紹介-2
〜福祉を評価するツールを紹介するサイト1:USDAのNational Agricultural Library〜
前回の「動物福祉の評価ツールのご紹介-1」では、本シリーズのイントロダクションとして、AVMA((American Veterinary Medical Association)主催の“学生動物福祉状況の評価コンテスト”を扱いました。
今回は、福祉を評価するツールを紹介するウェブサイトの第一弾として、アメリカ農務省(USDA, United States Department of Agriculture)の国立農業図書館(National Agricultural Library)に格納されている“Animal Welfare Assessments”のウェブページ(下図)を紹介していきたいと思います。
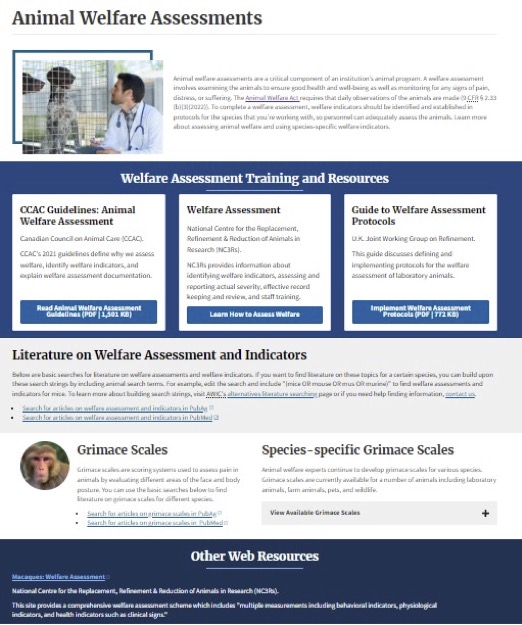
“Animal Welfare Assessments”のページはいくつかのパートに分かれ、“Welfare Assessment Training and Resources”(動物福祉の評価のトレーニングとリソース)、“Literature on Welfare Assessment and Indicators”(動物福祉の評価と指標に関する文献へのリンク集)、“Grimace Scale”(グリマス(しかめっつら)スケール)などが掲載されています。以下、掲載されている情報を順番に説明してみます。なお、情報は2023年1月現在のものです。

実験動物の里親制度
みなさんは実験動物の里親制度をご存知でしょうか。実験動物は実験終了後には基本的に安楽死されるのですが、近年では実験終了後の動物の里親を探して家庭に戻す、いわゆる里親制度が出てきました。記憶に新しいところでは2018年に酪農学園大から譲渡された実験犬の「しょうゆ」ちゃんがいます。
ペットになった元実験犬「しょうゆ」 獣医大生が譲渡願い出る
https://www.jiji.com/jc/v4?id=201812shouyu0001
こちらの記事にも記載がありますが、製薬企業でも実験終了後の犬の里親を探す動きが出てきています。実験動物の輸入販売会社の方はこう述べています。
「体への負担が重い実験、解剖が必須となっている実験などは安楽死させる必要がありますが、必ずしも処分する必要のない実験もあります。健康面などで問題がなければ、家庭犬として幸せに暮らせます」
今までは実験終了後はすべて安楽死してきたのですが、この制度が出来たおかげで安楽死せず家庭に譲渡できる可能性が出てきました。しかしその一方、すべての個体を譲渡できるわけではなく、命の選別を行わなければならないとのことで実験従事者に精神的負担を課す可能性も出てきました。
それでは里親制度の導入が進んでいる米国の状況を見てみましょう。NIH(米国国立衛生研究所)の実験動物福祉局では2019年に里親制度に関するオンラインセミナー(https://olaw.nih.gov/education/educational-resources/webinar-2019-06-13.htm)が開かれました。この中でAVMA(米国獣医師会)の研究用犬猫の里親制度に関するポリシーが掲載されていますので抜粋して紹介します。
・里親制度には研究機関の選任獣医師(Attending Veterinarian; AV)がプログラムの開発と監督に関与していなければならない。
・必ず AV または被指名者の承認を必要とし、AV または被指名者は、里親制度の申請を拒否する裁量と権限を持たなければならない。

動物福祉の評価ツールのご紹介-3 福祉を評価するツールを紹介するサイト2: NC3Rsの Welfare Assessment
前回の「動物福祉の評価ツールのご紹介-2」では、米国農務省USDAの“National Agricultural Library”の中にある“Animal Welfare Assessments” について紹介しました。
今回は、英国のNC3Rs(The National Centre for the Replacement, Refinement & Reduction of Animals in Research)が作成したガイドライン“Welfare Assessment”について紹介します。この文書は、USDAのNational Agricultural Libraryの中では”Welfare Assessments”として示されていて、前回は、このガイドラインが以下の情報を提供していることを報告しました。
●福祉指標の策定
●実際上の侵襲性(物理的および心理的傷害)の評価と報告
●適切な記録の保管方法とそのレビュー
●スタッフのトレーニング
今回は、それぞれの項についてもう少し踏み込んでいきます。

 日本獣医生命科学大学 横須賀誠, 北里大学獣医学部 佐々木宣哉 (JALAM教育委員会)
日本獣医生命科学大学 横須賀誠, 北里大学獣医学部 佐々木宣哉 (JALAM教育委員会)