- トップ
- コラム一覧

動物実験におけるPAM(Post Approval Monitoring)
動物実験は申請後に動物実験委員会等で承認され、実験を実施し、終了報告によって終了するといった一連の流れがあります。終了報告では申請時から逸脱した操作は無かったとか、申請時の使用予定匹数を超過するものではなかったなどの報告をしますが、それらが実際に報告通り行われていたかを知るすべが少ないのが現状です。そこで考えられたのがPAM(承認後モニタリング)という、実験が走っている最中に本当に申請通り行われているかを確かめるための仕組みです。
PAMは通常、動物実験委員会のメンバーや管理獣医師が行いますが、様々なタイプのものがあります。動物実験施設にふらっと入って、その場に居合わせた研究者に軽く質問をしながら何か困ったこと無い?と聞いてやりとりをするのもありますし、実験や手術などに立ち会って最初から最後まで手技についてチェックするのもあります。私は経験がありませんが、事前通告なしの抜き打ちによるPAMも存在するとのことです。

PAMを実施する際には苦痛度の高い試験や、中大動物の大規模手術、PAMを受けた経験のない人を優先して実施するところが多いようです。もちろん動物実験を実施する際には教育訓練を受講してもらいますが、何事もよくある話で、ある一定の割合で内容を理解していない人が必ず出てきます。そう言った意味でもPAMは現場でのセーフティネットの役割を果たしていると考えています。またPAMとセットで多いのが匿名の通報制度です。動物実験をする際に動物虐待があってはなりませんが、疑わしい場合があった際には匿名で通報できるようなシステムを採っています。これらの通報を受けて緊急のPAMを実施することもあります。研究の進捗はもちろん重要ですが、動物の命を扱っている以上、科学的根拠もなしに3Rsや5Freedomsを侵害してはならないからです。
PAMを実施する際には研究員からの反発も予想されますが、こと製薬企業においては品質保証、QA(Quality Assurance)の考えが根付いており、他者からチェックを受けることが日常茶飯事ですので案外スムースに実施できるといった印象です。個人で動くことの多いアカデミアなどではこう上手くはいかないかもしれません。
コラム 動物実験

動物実験従事者におけるCompassion Fatigueの分類(ProQOLを用いた分類)
Compassion Fatigueに対処する上で、最も重要なのは自分が今どのような状態にあるかを認識することです。その認識を手助けする分類方法として、Professional Quality of Life (ProQOL)というものがあります。
ProQOLは、相手と自らの職務との関連で感じるQOLの事と定義されており、ネガティブ・ポジティブの両側面を含むものとして概念化されています。つまり、相手がいる仕事において、ポジティブな方向に振れればそれはCompassion Satisfaction(共感満足:CS)であるし、ネガティブな方向に振れればそれはCompassion Fatigue(共感疲労、思いやり疲労:CF)であるとしています。さらにCFを2つに分類することができ、一般的にその仕事を続けられないと思えばそれはバーンアウト(燃え尽き症候群)であるし、その仕事を続けたいと思えば二次的外傷性ストレスだとされています。このようなProQOLを模式図化したものが以下の図です。
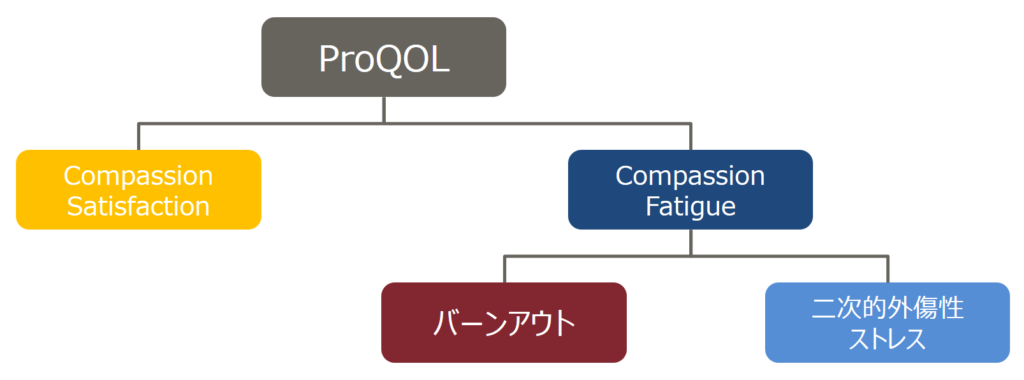
ProQOLは現在第5版が発行されていますが、日本語訳されたものは第4版が最新のものになっています(https://img1.wsimg.com/blobby/go/dfc1e1a0-a1db-4456-9391-18746725179b/downloads/Japanese.pdf)。第4版では30項目の問いから構成されており、その問いに対して0~5の6段階(0=まったくない、1=めったにない、2=たまにある、3=ときどきある、4=よくある、5=とてもよくある)でどの頻度で当てはまるかを数値化していき、その合計点で判断するといったものです。では具体的に項目を見ていきましょう。なお、項目は私の方で実験動物従事者用(特に飼育管理の方向け)にアレンジがしてありますので、公式なものではないことを申し添えておきます。

続いて自己採点方法です。
CSの平均点は37点です。上位約25%の人が42点以上、また下位25%は33点以下の得点です。42点以上であれば現在の仕事によってかなりの職業的満足感が得られていると考えられますが、33点以下であれば現在の仕事に問題を抱えているか、もしくは仕事以外の活動から満足感を得ているなど、他に理由がある場合も有ります。
バーンアウトの平均点は22点です。上位25%の人が27点以上、また下位25%は18点以下の得点です。18点以下であれば自身の業務遂行能力に関して肯定的な気持ちを持っていることを反映していますが、27点以上であれば効果的に自分の役割を果たせないのは仕事のどういった部分であるかについて省みたくなるかもしれません。
二次的外傷性ストレスの平均値は13点です。上位25%の人が17点以上、また下位25%は8点以下の得点です。17点以上の場合、仕事のどういう部分が恐怖感を与えているのかについてじっくり考える時間を持つことも良いかもしれません。高得点が必ずしも問題があることを意味するわけではありませんが、今の仕事や職場環境についてどう感じているのかを考察してみる方が良いのではないかという事を示唆しています。
今回の平均値などの得点はあくまでProQOLの基準であり、動物実験従事者に対してチューニングされたものではありません。ちなみに私はどの項目も平均点付近でしたので、どれにも合致しないといったごく普通の感じでしょうか。こちらは日本人と外国人である場合も結果が異なるでしょうし、飼育管理業務が主体的なのか、実験作業が主体的なのかによっても異なるかもしれません。いずれにせよ、このProQOLの概念が広がり、多くの方が実施することで信頼性が高まっていくと考えられますので、是非みなさんも実践して頂ければと思います。

新型コロナウイルス感染症研究における3Rs(in WC11)
The 11th World Congress on Alternatives and Animal Use in the Life Sciences(第11回 国際代替法学会;WC11)は2020年8月にオランダのマーストリヒトで開催する予定だったのですが、コロナの影響で2021年8月に順延されました。
2020年のWC11の開催は無くなりましたが、代わりにタイトルのウェビナー(https://wc11maastricht.org/webinar/)が無料で開催されることになりました。非常に興味深い内容ですし、YouTubeにアーカイブされており日本語(自動翻訳)の字幕を出すことも可能ですので、興味のある方は是非ご覧ください。個人的には2日目のジョンズホプキンス大学CATT(動物実験代替法センター)の方の講演が新型コロナ研究をゴールドラッシュのように例えていて面白かったです。
しかし代替法はあくまで他の試験を代替するものであり、今回の新型コロナウイルスなど試験自体が確立していないもの(動物実験もゴールドスタンダードと言われるものが確立していないもの)に対しては難しいということが明らかになってしまいました。もちろんiPS細胞などin vitroの試験を用いて研究していくことは必要ですが、スピード感が求められている中では動物実験と同時並行で進めていかざるを得ないのが現状です。この中でも私たちのような管理者が出来ることは、非常にシビアな感染実験などに対し、人道的エンドポイントを積極的に適用するなどのRefinementの実践だと考えています。

愛玩動物看護師の国家資格化に向けて
これまで獣医療に関する国家資格保有者は獣医師のみでしたが、このたび新たに動物看護師が「愛玩動物看護師」との名称で国家資格化されることが決定しました。この国家資格化には、獣医師法と現在の臨床現場における乖離が問題視されてきたことが背景にあります。
獣医師法は獣医師全般の職務・資格などに関して規定した法律ですが、臨床現場において獣医師以外の診療行為(採血、調剤、投薬、麻酔、レントゲン撮影など)を認めていません。しかし獣医師のみでこれら業務を対応するのは難しく、動物看護師によるこれら診療行為が黙認されている動物病院があることも以前から言われてきました。これらの声に対応すべく、医療現場における医師と看護師の関係のように、動物看護師が獣医師の指示の下で適切に診療の補助行為が行えるようにするため国家資格化されるとのことです。
では現在、環境省の愛玩動物看護師カリキュラム等検討会で審議されている、今後のスケジュールについて見ていきましょう。
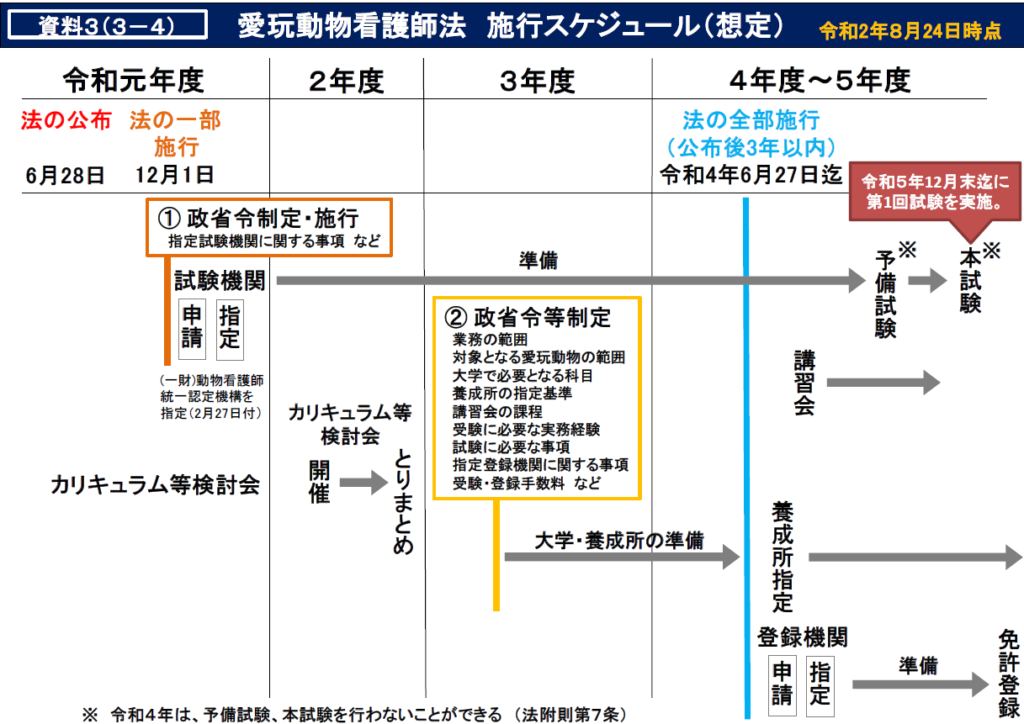
http://www.env.go.jp/nature/dobutsu/aigo/2_data/kangoshi/01.html
国家資格化されるということで、大きく変わることとしては国家試験が新たに作られます。これまでも公的資格化を目指して認定試験が行われてきましたが、診療補助行為が新たに認められることから、そのカリキュラムや試験内容は大幅に異なってくることが予想されます。基本的には大学や養成所指定された専門学校でコアカリキュラムをこれから学ぶ受験資格がありますが、既卒の方などには講習会に参加したり実務経験を証明することにより受験資格を与えられるとなっています。
また、愛玩動物看護師は臨床現場だけでなく、様々な場面での活躍が期待されています。具体的には、動物愛護管理法(動愛法)の中の「動物取扱責任者」の要件を見直し、愛玩動物看護師を加えることで、ペットショップやブリーダー等の第一種動物取扱業者が事業所ごとに選任義務のある「動物取扱責任者」として新たに動物愛護看護師の資格保有者を選任できるようにするとのことです。つまりはペットを扱う現場においては愛玩動物看護師などがいることが望ましいということですね。
愛玩動物看護師には私たち実験動物分野での活躍も期待しています。私たちの分野では「実験動物技術者」という資格が非常に重宝されています。動物福祉に対する考えや高度な実験技術などから資格保有者に対しては一定のレベルが担保されているとのことからの信頼なのですが、ここに新たに愛玩動物看護師の方のペットの目線からの動物福祉であったり、採血・投薬技術などが加わることで特に中大動物の動物福祉が一層進むのではないかと考えています。

コラム 実験動物

創薬に関わる特殊な実験動物たち
そして個人的には前から気になっている疾患モデル動物に「カイコ」がいます。

東大の名誉教授で、現在は帝京大学で研究されている先生が主体的に動いているプロジェクトなのですが、黄色ブドウ球菌などの細菌感染モデルや、カンジダなどの深在性真菌症のモデルも有しているとのことです。さらに薬物の静脈内投与、経口投与も可能(下図)とのことで、基本的な実験動物の要素は兼ね備えているように思いますが、あとは動物をいかにして安定供給できるかといったところでしょうか。試験を回していく上でこの部分はかなり重要ですので、本気でスクリーニング系として用いるのであれば飼育形態含め、色々と考えなければならない部分が多そうです。

http://www.genome-pharm.jp/
現在、ヨーロッパの動物実験ではイヌの使用が減って、逆にブタの使用が増えているとのことです。様々な理由が挙げられていますが、ペットとして用いられるような動物を使用するのは可哀そうといった感情論によるものが大きいと感じています。今はまだ小型魚類や虫を実験動物として使用することに反対は少ないと思いますが、近い将来、これらの動物であっても使用することが難しくなってくるのかもしれませんね。
コラム 実験動物

疾患モデル作製における動物種の選択
このように病気ひとつをとっても、そもそも人間の病態を再現する動物種を選択しなければ意味がありません。そう言った意味では人間に近縁なサルを使用することが理にかなっているように思えますが、安全性が全く担保されていない初期の治療薬をいきなりサルに投与することは倫理上の問題がありますし、体重の関係から貴重な治療薬を大量に使用してしまうことになります。そのため、動物実験を始める際には通常、マウスやラットなどの小動物から始める必要がありますが、これらの動物が人間の病態を再現できるかといった問題があります。以前は突然変異などによって偶然症状を発症した動物を選択的に交配していき、自然に症状を発症する個体を選んでいく自然発症モデルや、例えば慢性腎臓病であれば片方の腎臓を摘出するなどして人為的に病態を作り出す実験的発症モデルが良く用いられてきましたが、近年では病気の標的タンパクなどが明らかになっている場合(SARS-CoV-2に対するACE2など)、その標的タンパクの遺伝子を欠損させた(ノックアウト)動物や、逆に人間の標的タンパクの遺伝子を挿入した(ノックイン)動物などの遺伝子組換え動物を作製することで直接、標的タンパクとの相互作用を見ることが出来るようになってきました。
実際、中国のグループが人間のACE2をマウスで発現させ、SARS-CoV-2がマウスに高率に感染させることに成功したとの報告(https://www.nature.com/articles/s41586-020-2312-y)が既になされています。このように疾患モデル動物としては今後は組換え動物が積極的に利用されていくものと考えられますが、組換え動物の作製には半年程度の時間を要しますし、何より標的タンパクが同定されていない場合は使用することが出来ません。このような理由からまだ一定程度、自然発症モデルや実験的発症モデルの使用は続いていくものだと考えられます。
| (本コラムの引用文献は、クリエイティブコモンズライセンスの下に提供されています。) |
コラム 実験動物

動物実験の情報発信(イギリス編)
コミュニケーション

コミュニケーションは情報発信において非常に重要な役割を果たします。UARが設立された当初はテレビや新聞などマスメディアで動物実験擁護活動を展開していましたが、現在ではインターネットやソーシャルメディアでの発信に切り替わってきているようです。動物実験反対派の事実に異なる主張に対し、正しい情報を公開し、その意義を訴えるという姿勢を明確にしており、このことによりメンバーや組織が動物実験に改めて理解を深めることで、さらに自信をもって自らの立場を鮮明にアナウンスすることも出来るようになってきているとのことです。つまりは情報発信側のトレーニングにもなっているようですね。
また、情報開示に関する活動として、UARではweb上で動物実験施設のバーチャルツアーを開設(http://www.labanimaltour.org/)しています。
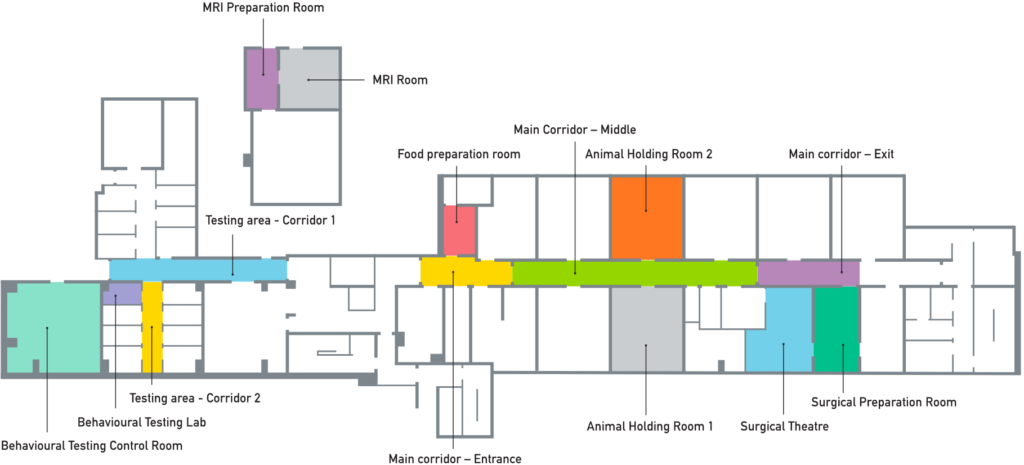

上の写真はオックスフォード大学の動物実験施設のバーチャルツアーです。公開している部屋は限られますが、色の付いている部屋はすべて見ることが出来ますし、Googleのストリートビューのように360度ぐるぐる回して見ることが出来ます。また驚くべきことに、このようにサルに電極を付けた非常にシビアな試験を公開しており、逆にオックスフォードの動物実験に対する透明性を高めるものになっています。
このようにUARの様々な活動を見てきましたが、イギリスでは長年これらの活動に取り組んできただけあって非常に洗練されたものとなっています。現在、日本でもUARの活動を見習って情報発信活動を始める動きが出てきていますが、それにはまず現在の閉鎖的な環境を打破し、胸襟を開いて、動物実験はそもそも何のために行っているのかという原点に立ち返って正しい情報発信を進めていく必要があると考えています。