- トップ
- コラム一覧
教育委員会 の記事一覧

遺伝性疾患の研究における実験動物の役割と課題〜筋ジストロフィーモデル動物を例に〜
1. 遺伝子変異の解析とモデル動物の作製
筋ジストロフィーは、40種類以上の遺伝子のいずれかに変異が生じて発症する遺伝性筋疾患の総称です(1)。原因遺伝子によって違いはありますが、進行性の筋力低下と骨格筋の組織変性を主徴とする致死的な疾患です。患者数が最も多いデュシェンヌ型筋ジストロフィー(DMD)は、筋細胞膜の構造維持に不可欠な蛋白質をコードするジストロフィン(DMD)遺伝子の変異が原因で発症するX連鎖劣性遺伝疾患です(2)。DMD遺伝子は78個のエクソンから構成される全長2.4 Mbの巨大な遺伝子です。このような巨大な遺伝子上に多様な変異が様々な箇所に生じるため、診断や治療法の開発が困難となっています。
DMD遺伝子の変異の型は、コドンの読み枠がずれる「アウト・オブ・フレーム型」と読み枠が維持される「イン・フレーム型」に大別されます。前者のアウト・オブ・フレーム型変異ではジストロフィン蛋白質が産生されないため重症のDMDとなりますが、後者のイン・フレーム型変異では短いジストロフィンが産生されるため、多くは軽症のベッカー型筋ジストロフィー(BMD)と診断されます。これらの型はさらに欠失や重複、点変異など様々な変異によって生じるだけでなく、現在では変異パターンに応じて予後が異なることが明らかとなりつつあります(3)。変異の種類に応じた病態を理解するためには、患者と同様な変異を持つ遺伝子改変動物が必要です。しかし、欠失だけでも500種類以上が報告されている変異に対して、それぞれのモデル動物を作製することは現実的ではありません。そこで活躍するのが、遺伝子変異の種類や頻度、症状などの様々な情報がまとめられているデータベースです。DMDを含む遺伝性筋疾患の分野においてもいくつかの国家規模または国際的規模のデータベースを利用することできます(3)。このような情報を利用することで、発生頻度の高い変異や重症度を調べることができます。すなわち、無数にある変異の中から「どのような変異を持つモデル動物を作製すべきか」の指針となる情報が得られる場合があります(図1)。
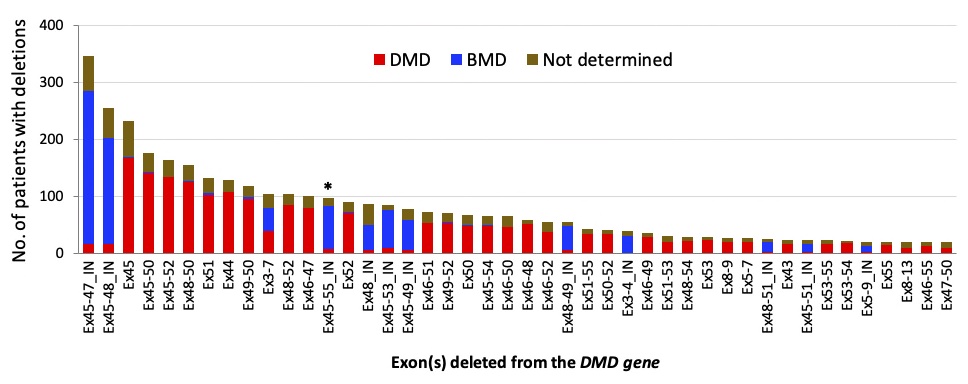
図1 遺伝性疾患の国際的open database(LOVD: https://www.lovd.nl/)を用いて解析されたDMD遺伝子の欠失変異の頻度と重症度スペクトラム。赤は重症のDMD、青は軽症のBMDを示す。Ex, エクソン(数字は欠失したエクソンの番号); IN, イン・フレーム変異(短縮型ジストロフィンの産生が可能な変異)。記載のない項目は全てジストロフィンを産生できないアウト・オブ・フレーム変異を示す。Echigoya Y, et al. J Pers Med. 2018, licensed under CC BY 4.0.

がんも遺伝する:モード・スライの功績
近交系黎明期
以前のコラムでクラレンス・リトルと共に登場したアビー・ラスロップは、1900年、マサチューセッツ州グランビーでペット用の小動物の繁殖会社を起業する。彼女が所有したJWMのペアなど様々な種類の小動物は、ペットとして飼われる他に、全米の多くの研究者から注文が相次いだ。1900年に、メンデルの法則の再発見に関連する論文が発表され、多くの研究者が、同法則の動物への適用に関心を持ったのも一因である。ラスロップが収集・生産したマウスは、すでに毛色などを指標に近親交配を繰り返しており血縁係数が高いものであったようだ。1908年には早くも、ラスロップは、生活環境はほぼ同じであるにもかかわらず、JWMを含むマウスの家系によって、腫瘍の発生部位や発生率が異なることに気づく。1918年までに(この年、彼女は他界)、病理学者のローブと共に、数世代に渡る遺伝実験を行い、マウスの癌の遺伝に複数の因子が関与している可能性を示した [6]。アーネスト・ティザー(ティザー病で有名)も、1907年、マウス家系によって自然発生する腫瘍の発生率が異なることを報告している [7]。
前コラムの繰り返しになるが、リトルとティザーは、JWMに生じた肉腫の雑種への移植は成功するが、逆方向の移植は拒絶されるという発見をした [8]。この観察からリトルは、がんの研究を進めるためには、遺伝的に非常に近い近交系(純系)動物を作らねばならないと考え、1919年にDBAという純系のマウスを作出した。この発見は、1936年の主要組織適合性複合体およびH-2抗原の発見へと発展していくが、近交系動物が医学・生物学の進歩に及ぼした貢献は計り知れない。
新しい概念の発見が、同時に複数の研究者によってなされることがある。最近では、免疫チェックポイント阻害薬の抗PD-1/ PD-L1抗体、抗CTLA-4抗体であろうか(本庶佑とジェームズ・アリソンが2018年ノーベル生理学医学賞)。ラスロップ、リトル、ティザー達と同時代に、ひっそりと純系マウスを育て研究している人がいた。

マウスやラットの技術トレーニングで使用される代替法教材
1. シミュレーター(模型)
・マウスシミュレーター: Mimicky® Mouse
Mimicky® Mouseはマウスの質感やサイズ、重量などを精巧に再現したシミュレーターです。初心者を対象としたシミュレーターであり、動物の抑え方や投与の手順などを確認する際に使用されます。尾の部分には模擬血管が埋め込まれており、尾静脈投与の練習が可能です。尾は本体と取り外しできるようになっており、尾の部分だけ別途購入し付け替えて使用することができます。マウス個体のシミュレーターは世界的に珍しく、その再現性の高さから海外からの評価も高いようです。Mimicky® Mouseの使用例についてはここから動画で確認できます。
また、同社よりサルの静脈採血・投与のシミュレーター(Mimicky® Vessel)も販売されています。
・マウスの尾静脈投与・採血のシミュレーター:マウス尾静脈シミュレーター
尾静脈からの投与・採血に特化したシミュレーターで、尾の部分のみの形で日本クレア株式会社から販売されており、ここから使用方法の動画を視聴できます。シリコン製の尾の内部に尾静脈のチューブが2本埋め込まれており、マウスの尾静脈が精巧に再現されています。保定器に接続し、インクなどの模擬血液をチューブ内に充填後、採血・投与のトレーニングを行います。実際に生体で投与・採血を行う時と比べて難易度はやや低く設定されており、初心者が手順を覚える上で調度よい難易度になっています。また材質の特性から耐久性が高く、繰り返し使用することができます。

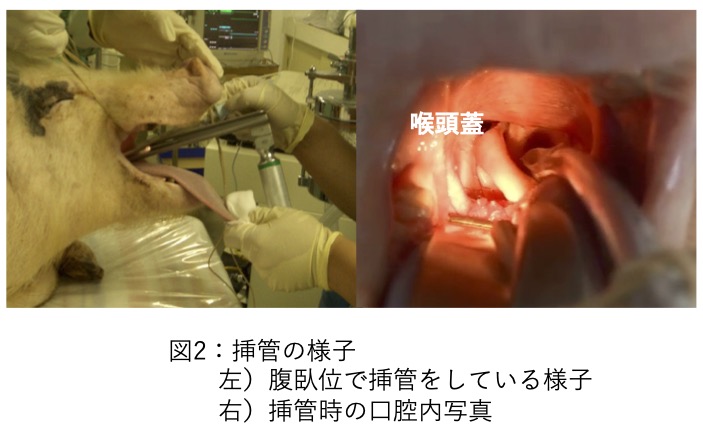
・ラットシミュレーター:NATSUME RAT
ラットの基本手技を訓練するための初心者用シミュレーターの一つです。訓練可能な技術は保定、経口投与、尾静脈内投与・採血、気管挿管です。NATSUME RATは比較的古くから使用されてきた国産シミュレーターですが、近年リニューアルが行われ、材質が改良されました。ラットシミュレーターについては国内外で複数のものが存在します。実物のラットと各ラットシミュレーターの形態的な比較を調査した論文で、NATSUME RATは他のシミュレーターと比較し、頭部の形状や血管の位置、尾の構造をはじめとした各部位において形態の再現度が高かったと報告されています(1)。

国内承認ワクチンの非臨床試験を垣間見る 〜ワクチン開発と動物実験〜
日米EU医薬品規制調和国際会議(ICH)での合意に基づき、「医薬品の臨床試験のための非臨床試験の実施時期についてのガイドライン」が2010年に改正され、「医薬品の臨床試験及び製造販売承認申請のための非臨床安全性試験実施についてのガイダンス」がまとめられて現在に至っている (ICH-M3{R2})3)。この改正の主な目的は、承認審査資料の国際的なハーモナイゼーションを推進することにあり、「動物実験の3Rsの原則」に従うこと、および「早期探索的臨床試験のための非臨床試験」という概念を導入することなどにあり、これ以降、毒性試験や薬理試験など12の試験項目の安全性(Safety)についてICHガイドラインが各々整備されてきている (ICH-S1~S12)。
臨床第Ⅰ相試験の初期に実施される「早期探索的臨床試験」に応じて、ヒト初回投与試験までに実施すべきマイクロドーズ試験や単回投与毒性などの非臨床試験が、げっ歯類および非げっ歯類を用いて実施される。すなわち「早期探索的臨床試験の開始時までに実施される非臨床試験は一部にすぎず、実施予定の臨床試験の時期や期間に応じて非臨床試験がデザインされる」のが一般的である。
この分野の専門家ではない著者の私見ではあるが、「ほとんどの動物実験(試験)がヒト臨床に先だって実施されるもの」という、現実からやや乖離した先入観が社会の根底にあるように感じている。時に動物実験(試験)は「非臨床試験(前臨床試験)」などと記載されることもあり、研究者による社会に向けた正確な情報発信という点で誤解を生み易い表現には都度解説する必要があると自戒を込めて考えている。
【参考アドレス】
1. 独立行政法人医薬品医療機器総合機構(PMDA) 「医療用医薬品 情報検索」
2. 一般社団法人日本医薬情報センター(JAPIC) 「医薬品情報データベース (iyakuSearch)」
3. 独立行政法人医薬品医療機器総合機構(PMDA) 「ICH 医薬品規制調和国際会議 ガイドライン 」