がんも遺伝する:モード・スライの功績

現在では、化学物質、活性酸素、ウイルス感染、生活習慣や加齢など、さまざまな原因により複数の遺伝子に異常が生じ、がんが生ずることがわかってきている。本コラムでは、実験動物学の黎明期である1900年代初頭の化学発がん説やウイルス発がん説が優勢な頃、マウスを用い、がん遺伝説を提唱したモード・スライ(Maud Slye)を紹介します。
独楽鼠(こまねずみ)
リンネが名付けたマウスの学名「Mus musculus(ラテン語)」のmusは古代サンスクリット語の「泥棒」を意味するmushaに由来している。ディズニーが自室に迷い込んだマウスを餌付けし、このマウスを参考にキャラクターを考案したというのは架空の話のようだが、招かれざる客が、歓迎すべき客となり、飼い慣らし繁殖したものが現在の愛玩用マウス(ファンシーマウス)になったとの説が有力である。他の愛玩動物と同様、古代より愛好家たちは、興味深い毛色や行動パターンを持つ珍しいタイプを選んで交配・維持してきたようだ。1920年代には、英米でマウス愛好家組織が結成されたほどポピュラーな存在になった。このムーブメントは1927年のミッキーマウスの誕生にも影響を与えたかもしれない。
1890年代の米国では、ワルツを踊るようにくるくる回る、ジャパニーズワルチングマウス(Japanese waltzing mouse :JWM)がペットとして人気を博した。心理学者のロバート・ヤーキーズは、このマウスの由来や習性を調べ本にまとめている [1]。このワルツを踊るマウスは、紀元前の中国の漢の時代の文献に登場している。日本では独楽鼠または舞鼠と言われていた。JWMは、中国から日本を経て欧州に到着し、その後、米国に上陸したと思われる。ヤーキーズが所有したJWMは、白地に黒の斑点や縞模様が入っていたことから、JF1マウス(パンダマウス)と同様、エンドセリン受容体B型遺伝子(Ednrb)の変異をもっていたのであろう [2]。JWMは、旋回運動を示すほか難聴でもあり、これらの症状は、遺伝性の内耳の構造異常に起因する場合が多い。平衡感覚がおかしいので、体勢を維持するために旋回するのである。この表現型(遺伝変異)を持つマウスは1947年にジョージ・スネルによってジャクソン研究所へ導入後、近交系C57BL/10に交配することで変異遺伝子が維持され、現在でも同所に受精卵が凍結保存されている[2]。2001年に、聴覚と平衡感覚器官の異常の原因としてカドヘリン23遺伝子の変異が同定された [3, 4]。また、カドヘリン23は、人の先天的難聴を伴う遺伝病であるUsher症候群の原因遺伝子と同一であることが判明した [5]。
関連記事
実験動物の微生物検査
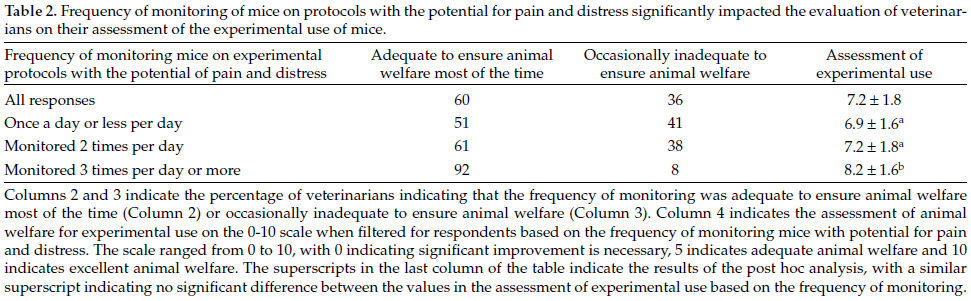
実験動物は一般に販売されている動物と異なり、特定の病原体を有していないことが明らかになっているSPF(Specific Pathogen Free)動物が多く用いられています。これは病原体が動物に与える影響(ノイズ)を排除するためなのですが、では一般の動物はどの程度、病原体に汚染されているのでしょうか。2015年に日本国内のペットショップで販売されているマウスの病原体保有状況を調べた報告(Hayashimoto N et al. Exp Anim. 2015;64:155-160.)がありますが、そちらの報告によると神奈川県と東京都の5つのペットショップに由来する28匹のマウスを検査したところ、以下のような結果(検出率)が得られたとのことです。
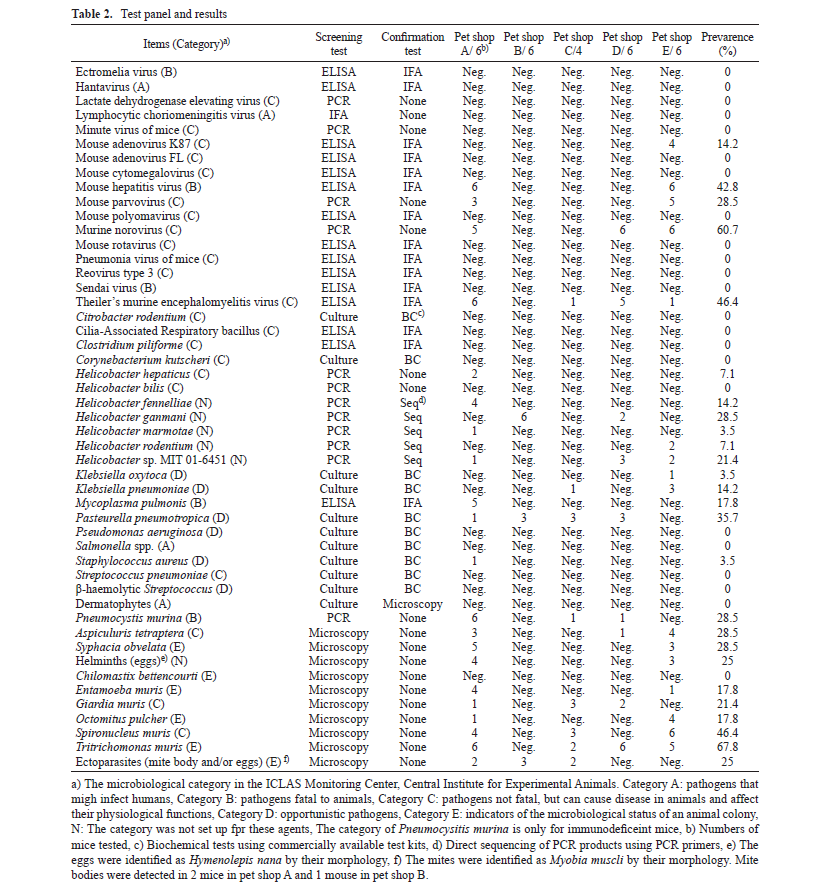
このようにペットショップごとにその検出率は異なるものの、多くの動物が微生物汚染を受けていることが分かりました。なお、人獣共通感染症を引き起こす病原体は検出されませんでしたが、動物に影響を及ぼす病原体は複数のペットショップから検出されています。これらの病原体は一般に飼育されている状態では特に問題がないことも多いのですが、動物実験に用いる際には状況が変わってきます。冒頭でも述べましたが、実験動物は余計なノイズを排除する必要があります。「再現性」は動物実験において最も重要な一つの要素ですが、動物によって病原体を持っていたり持っていなかったりすると、動物の状態が安定せず、試験結果の信頼性に影響する場合があります。また、このことによって実験に用いる動物の数が多くなってしまうことは避けるべきです。

ARRIVEガイドライン2.0が公開されました
7月14日にNC3Rs(英国3Rセンター)にてARRIVEガイドライン2.0が公開(https://arriveguidelines.org/)されました。2010年に初めて公開されたARRIVEガイドラインは、動物実験計画において最低限記載すべき項目をまとめたものであり、Natureをはじめ多くの学術雑誌に支持されているガイドラインです。
そもそもこのガイドラインが作成された背景には、動物実験の再現性があまりにも低い(一説には70%以上の実験が再現できない)と言われてきたことがあります。その一因として実験方法の詳細が述べられていないとの指摘がありました。
英国の機関が、動物実験の記載がある271報(1999-2005)の論文を精査したところ、研究の仮説・目的を記載し、かつ動物の数と特徴が記載されていたのは271報のうち、わずか59%であったことを報告(https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0007824)しています。
これらの事を受けてNC3Rsは記載すべき20の項目を定めて2010年にARRIVEガイドラインとして発表しました。多くの研究機関や出版社から支持されてきたものの、記載項目が多いことからも問題の根本的な解決には至りませんでした。そこで改訂版であるARRIVEガイドライン2.0が新たに公開されました。
ARRIVEガイドライン2.0の主な変更点は以下のとおりです。
記載すべき最低限の項目を10項目に絞った「ARRIVE Essential 10」とそれらを補完する「Recommended Set」に分類した
ARRIVE Essential 10は以下のとおりです。なお正式な日本語訳は日本実験動物学会等、公的機関によるアナウンスをお待ちください。
1. Study design(研究計画)
2. Sample size(サンプルサイズ)
3. Inclusion and exclusion criteria(包含基準と除外基準)
4. Randomisation(ランダム化)
5. Blinding(盲検化)
6. Outcome measures(実験の帰結)
7. Statistical methods(統計学的方法)
8. Experimental animals(実験動物の情報)
9. Experimental procedures(実験処置)
10. Results(結果)
前回のガイドラインが20項目であったことからも項目数を絞って記載しやすくなっていることが分かります。通常の動物実験審査においては3~5の項目を審査することは少ないのですが、今後はこのあたりも審査することが求められてくるかもしれません。

 北里大学獣医学部 佐々木宣哉(JALAM教育委員会)
北里大学獣医学部 佐々木宣哉(JALAM教育委員会)