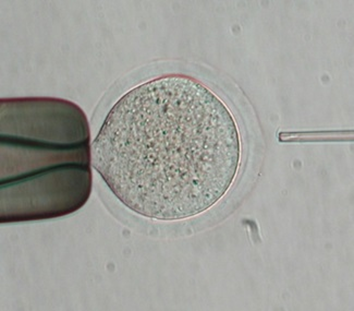
人道的エンドポイント
コラム 動物実験

通常、動物実験では終了時の目標を定め、その目標に到達した時点で実験を終了し安楽死処置を施します。その目標到達時点を実験のエンドポイントと呼びますが、感染症やがんなど、非常にシビアな実験では死がエンドポイントと設定されている場合が数多くあります。しかし最近では動物福祉の観点から、死をエンドポイントとするのではなく、死に繋がる兆候、もしくはこれ以上は得られる成果よりも動物の苦痛度が高いと判断される兆候が見られた時点をエンドポイントと定め、その時点で安楽死処置することで動物に不要な苦痛を与えないようにするといった考えが広がってきました。この安楽死処置するタイミングの事を人道的エンドポイント(Humane Endpoint)と呼びます。
人道的エンドポイントを少し具体的に見ていきましょう。感染症の実験は非常にシビアなものであり、一般的には生死で判断する場合が多く、縦軸に生存率、横軸に感染後の経過日数をプロットした生存曲線を描く場合があります。
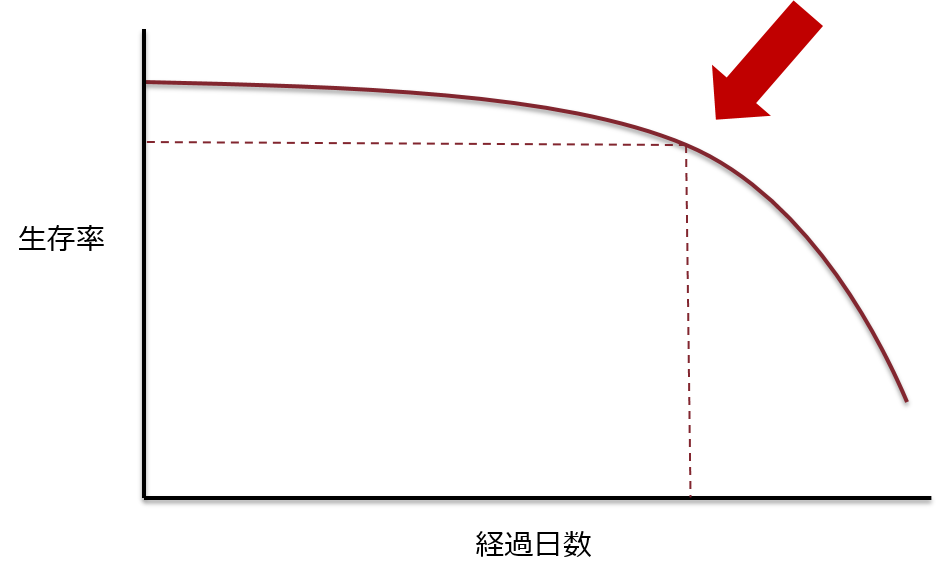
矢印の時点に注目して頂きたいのですが、このあたりから生存率が急に下がる(=死亡個体が多くなる)ことが分かります。この後の死亡に繋がる何らかの所見がこの時点、もしくはもう少し前の時点で得られれば「その所見を得た〇日後に死亡する」といったデータが得られるのです。
その所見には以下のようなものが例として挙げられます。
● 摂餌量の低下
● 体重減少
● 体温の低下
● 外貌所見(見た目の変化)
中でも外貌所見は動物の状態を非常に鋭敏に捉えることが出来ます。2010年、Nature Methodsに非常に興味深い論文が掲載されました。マウスの表情によって苦痛度を推測するといった論文です。
Langford, D., Bailey, A., Chanda, M. et al. Coding of facial expressions of pain in the laboratory mouse. Nat Methods 7, 447–449 (2010). https://doi.org/10.1038/nmeth.1455
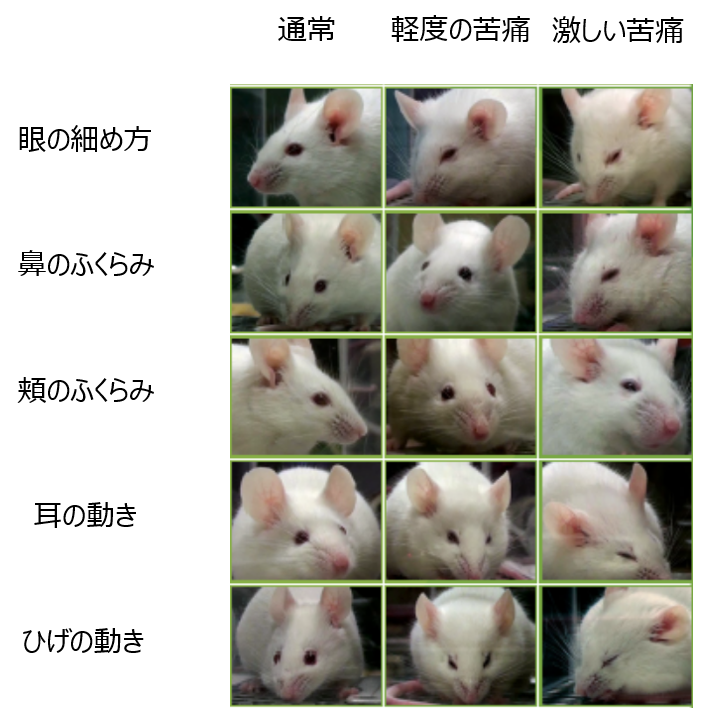
このマウスの表情はグリマススケール(しかめっ面の尺度)として知られ、現在ではマウスに限らず多くの動物で作成されています。このように動物の苦痛度を可視化し、スコア化することで各々の感覚に頼っていたものを標準化することが出来るようになってきました。これらを用いることで動物の不要な苦痛を削減すると共に実験を早期に終了することが出来、研究のスピードが増したとも言われています。
このように現在の研究現場では研究者、飼育管理担当者、管理獣医師などが協力して動物の苦痛を除去し、研究の進捗を早める努力が続けられています。
関連記事
実験動物の微生物検査
実験動物は一般に販売されている動物と異なり、特定の病原体を有していないことが明らかになっているSPF(Specific Pathogen Free)動物が多く用いられています。これは病原体が動物に与える影響(ノイズ)を排除するためなのですが、では一般の動物はどの程度、病原体に汚染されているのでしょうか。2015年に日本国内のペットショップで販売されているマウスの病原体保有状況を調べた報告(Hayashimoto N et al. Exp Anim. 2015;64:155-160.)がありますが、そちらの報告によると神奈川県と東京都の5つのペットショップに由来する28匹のマウスを検査したところ、以下のような結果(検出率)が得られたとのことです。
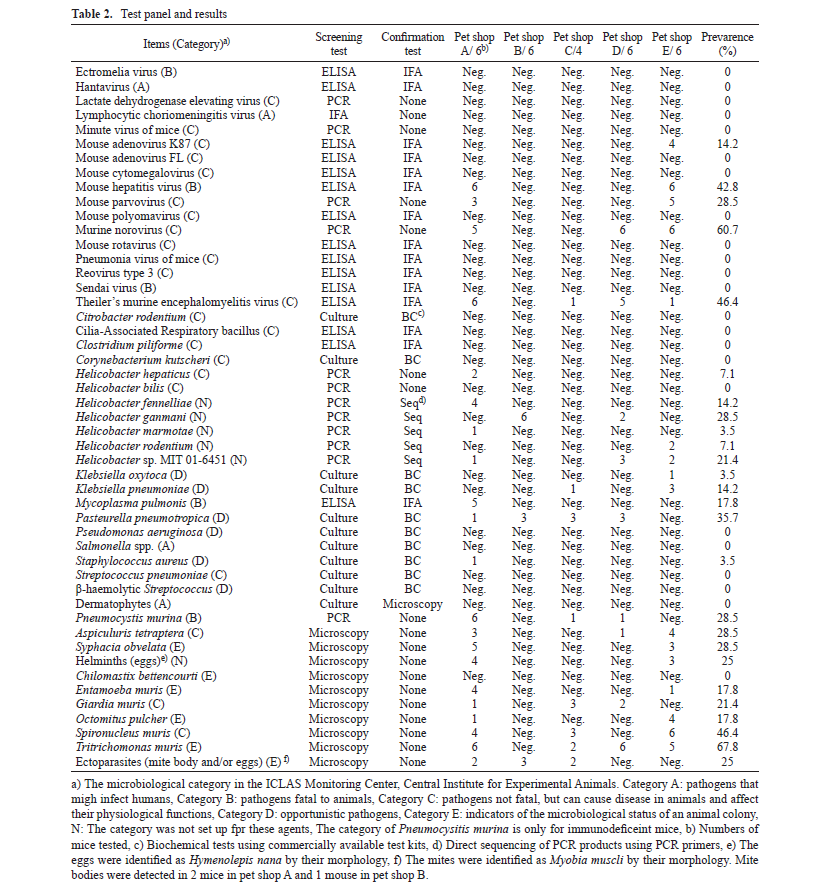
このようにペットショップごとにその検出率は異なるものの、多くの動物が微生物汚染を受けていることが分かりました。なお、人獣共通感染症を引き起こす病原体は検出されませんでしたが、動物に影響を及ぼす病原体は複数のペットショップから検出されています。これらの病原体は一般に飼育されている状態では特に問題がないことも多いのですが、動物実験に用いる際には状況が変わってきます。冒頭でも述べましたが、実験動物は余計なノイズを排除する必要があります。「再現性」は動物実験において最も重要な一つの要素ですが、動物によって病原体を持っていたり持っていなかったりすると、動物の状態が安定せず、試験結果の信頼性に影響する場合があります。また、このことによって実験に用いる動物の数が多くなってしまうことは避けるべきです。

ARRIVEガイドライン2.0が公開されました
7月14日にNC3Rs(英国3Rセンター)にてARRIVEガイドライン2.0が公開(https://arriveguidelines.org/)されました。2010年に初めて公開されたARRIVEガイドラインは、動物実験計画において最低限記載すべき項目をまとめたものであり、Natureをはじめ多くの学術雑誌に支持されているガイドラインです。
そもそもこのガイドラインが作成された背景には、動物実験の再現性があまりにも低い(一説には70%以上の実験が再現できない)と言われてきたことがあります。その一因として実験方法の詳細が述べられていないとの指摘がありました。
英国の機関が、動物実験の記載がある271報(1999-2005)の論文を精査したところ、研究の仮説・目的を記載し、かつ動物の数と特徴が記載されていたのは271報のうち、わずか59%であったことを報告(https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0007824)しています。
これらの事を受けてNC3Rsは記載すべき20の項目を定めて2010年にARRIVEガイドラインとして発表しました。多くの研究機関や出版社から支持されてきたものの、記載項目が多いことからも問題の根本的な解決には至りませんでした。そこで改訂版であるARRIVEガイドライン2.0が新たに公開されました。
ARRIVEガイドライン2.0の主な変更点は以下のとおりです。
記載すべき最低限の項目を10項目に絞った「ARRIVE Essential 10」とそれらを補完する「Recommended Set」に分類した
ARRIVE Essential 10は以下のとおりです。なお正式な日本語訳は日本実験動物学会等、公的機関によるアナウンスをお待ちください。
1. Study design(研究計画)
2. Sample size(サンプルサイズ)
3. Inclusion and exclusion criteria(包含基準と除外基準)
4. Randomisation(ランダム化)
5. Blinding(盲検化)
6. Outcome measures(実験の帰結)
7. Statistical methods(統計学的方法)
8. Experimental animals(実験動物の情報)
9. Experimental procedures(実験処置)
10. Results(結果)
前回のガイドラインが20項目であったことからも項目数を絞って記載しやすくなっていることが分かります。通常の動物実験審査においては3~5の項目を審査することは少ないのですが、今後はこのあたりも審査することが求められてくるかもしれません。

 JALAM学術集会委員会
JALAM学術集会委員会