- トップ
- コラム一覧
JALAM学術集会委員会の記事一覧

実験動物のケージサイズ
と言うのも、実験動物の分野では動物福祉を念頭に入れながら飼育することはもちろんですが、多くの科学者たちが協力し、科学的根拠に基づいてケージサイズを決定してきた背景があります。現在、米国をはじめ世界中の多くの国で採用されているイヌのILAR (Institute for Laboratory Animal Research)の基準(ILAR Guide)、そしてまだ採り入れている国は少ないものの動物福祉に先進的なEUの基準(ETS 123)は以下のとおりです。
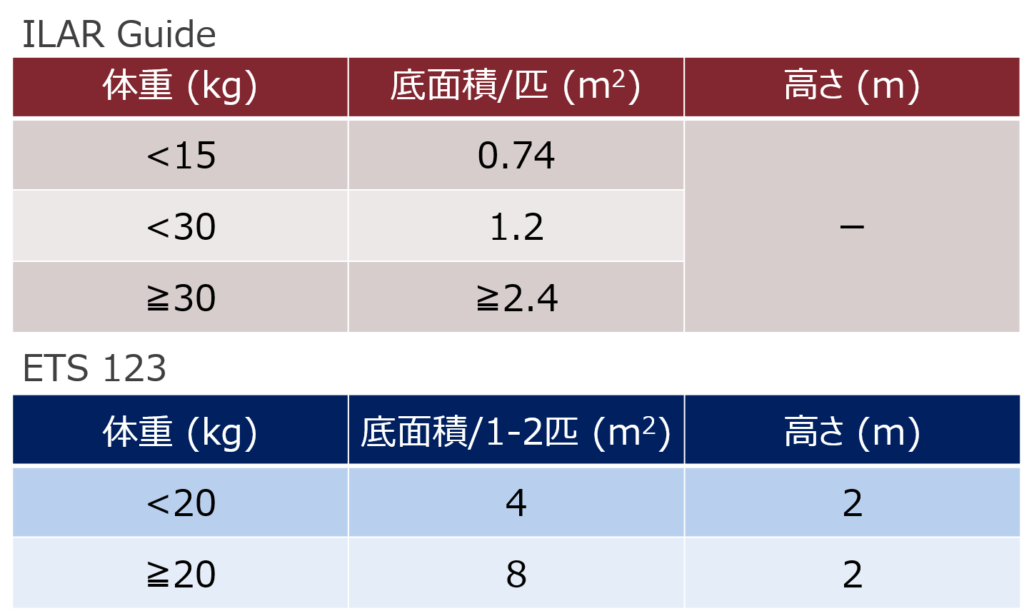
ILAR Guideは多くの改訂を経て、2011年に発行された第8版が最新のものになっています。この第8版を発行する際にはケージのサイズが大きく変更されましたが、研究者とブリーダーなどの業界団体との交渉が盛んになされた結果、こちらで落ち着いたと伺っています。その理由としてEUのように動物福祉を推進することはもっともですが、それによって実験動物が飼育できなくなり、結果的に研究の進捗が妨げられる事態は避けなければならないからです。そう言った意味で、ILARの基準は動物行動学などの科学的根拠と動物福祉の折り合いがついた結果だと考えられているため、多くの国で採用されているのだと私自身は考えています。
こういった科学的根拠なしに、かつ、業界との落としどころを見つけることなく様々な基準を決定すると、表に出てこない部分での飼育が広がる恐れがあり、結果として不幸な動物が増えてしまうのではないかと懸念しています。環境省の基準案は検討会に環境大臣が出席するほどの力の入れようですので、覆ることは恐らくないとみています。今回、このように舵を切ってしまったわけですから経過措置の期間やケージや施設の改作に関する補助など様々なサポートに関して今後議論して頂きたいと思います。
翻って我々の業界もILARサイズに収まっていればそこで飼い続けても良いのかといった問題はあるため、今回の環境省の基準案にある分離型の考えにある、定期的な運動は必要でしょうし、ゆくゆくはEUの基準での飼育が求められるものだと考えています。しかしそれには飼養数の減少が必要ですし、そのためにはイヌでの実験に代わる代替法の開発が急務であると考えています。
コラム 動物実験

実験動物の安楽死方法
愛玩動物や展示動物などの終生飼育動物とは違い、実験動物は非終生飼育動物であるため、基本的には安楽死によってその生涯を終えます(里親制度除く)。動物実験従事者が守るべきガイドラインのひとつでもある、環境省の「実験動物の飼養及び保管並びに苦痛の軽減に関する基準」には安楽死に関する以下の記載があります。
実験動物管理者、実験実施者及び飼養者は、実験等を終了し、若しくは中断した実験動物又は疾病等により回復の見込みのない障害を受けた実験動物を殺処分する場合にあっては、速やかに致死量以上の麻酔薬の投与、頸(けい)椎(つい)脱臼(きゅう)等の化学的又は物理的方法による等指針に基づき行うこと。
この事を受け、各施設では独自に安楽死に対する規程を作成し実施していると思いますが、それらの規範となるものがAVMA(米国獣医学会)の安楽死に関するガイドライン(https://www.avma.org/resources-tools/avma-policies/avma-guidelines-euthanasia-animals)です。
こちらのガイドラインは実験動物に限ったものではなく、愛玩動物や産業動物など様々な分野の動物に対する安楽死方法が科学的視点から規定されています。安楽死に関しては動物が苦しむことなく死を迎える必要があり、それにはどうしても科学的根拠が必要になるため、このガイドラインは国内の各施設でも非常に重宝されています。また本ガイドラインは2020年に更新された非常に新しいものです(7年ぶりに更新)。
動物実験関係者だけでなく、動物に関わる全ての方に見て頂きたいガイドラインなのですが、いかんせん英語で全121ページという膨大な量のため足踏みしてしまう方が多いと思います。その時に参考になるのがミシガン大学のガイドライン(https://az.research.umich.edu/animalcare/guidelines/university-michigan-euthanasia-guidelines)です。
こちらはAVMAガイドラインとは異なり、イヌでCO2での安楽死が不可になっているなど若干の改変はありますが、実験動物としては現場に即したものであり、なおかつペントバルビタールなどのバルビツールによる静脈内麻酔など優先度の高い化学的安楽死方法が上に来ていることも動物に対する苦痛度を考えた上で非常に使いやすいものとなっています。
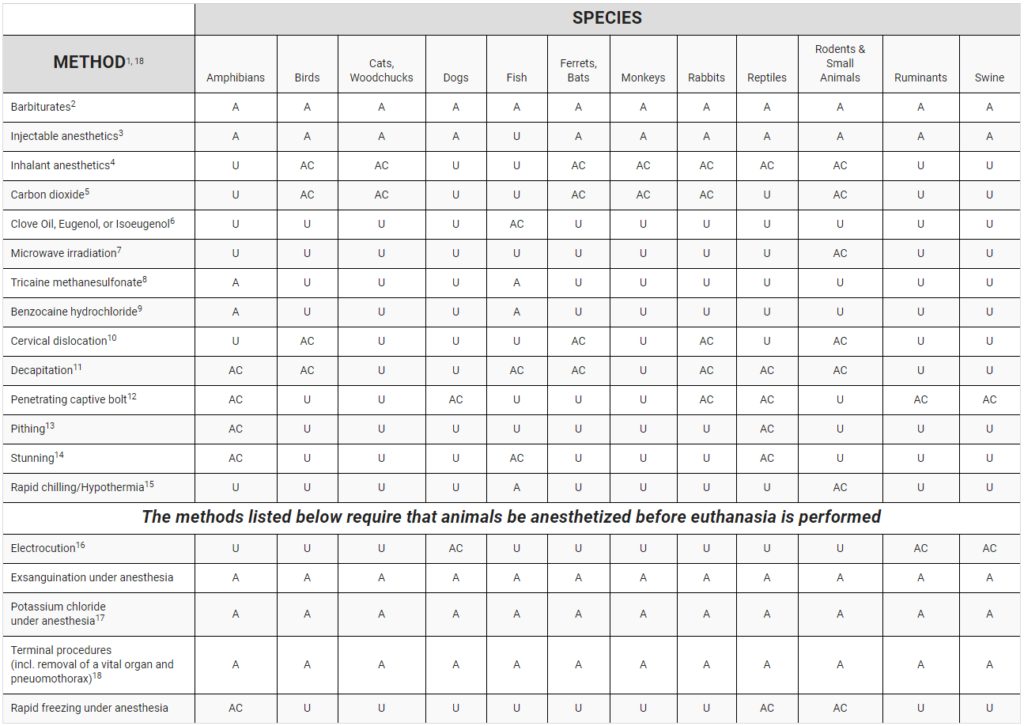
なお、表の読み方は以下のとおりです。
A = Acceptable – those which consistently produce a humane death when used as the sole means of euthanasia
AC = Acceptable with Conditions – those which consistently produce a humane death when specific conditions are met
U = Unacceptable – deemed inhumane under any conditions, or found to pose substantial risk to human applying the technique
そしてここからは非公式になりますが、私の方で勝手にこのミシガン大学の安楽死ガイドラインの表を翻訳してみました。
-1024x657.png)
安楽死に関する情報は日進月歩の状態です。前回2013年の時にはCO2での安楽死は10~30%/minでの流速で容器内の空気を置換していくと良いとされていたのですが、今回の改訂では30~70%/minで置換していく方が実は動物にとって負担が少なかったとの報告がなされています。また、魚類の安楽死も現在は化学物質による安楽死法がメインですが、2019年にヨーロッパで開催された学会では低体温での安楽死の方が苦痛が少ないことが示唆されたとの報告もされています。このように安楽死といった最後にできる実験処置としては、動物の苦痛の軽減を何よりも優先して、情報をアップデートしていく必要があると考えています。

実験動物の里親制度
このように研究機関においては実験動物の健康と福祉を管轄する選任獣医師の承認が必須になっています。さらに演者が所属しているブラウン大学の譲渡動物の基準が説明されていますので併せて紹介します。
・譲渡される動物は健康で、行動に問題がないことが確認されていなければならない。
・FDAが承認した人用もしくは動物用医薬品、サプリメント、もしくは動物用医薬品の薬品グレード化合物以外の物質を投与されていないこと。
・感染性物質に曝露されていないこと。
・遺伝子組換え、もしくは免疫抑制動物ではないこと。
・職員もしくはその家族のペットとしてのみ許可され、販売されないこと。
・人用もしくは動物用の食料とされないこと。
・里親は将来に渡って獣医学的ケアが必要な場合は責任を持つこと。
大学と製薬企業では譲渡条件も異なるとは思いますが(製薬企業は承認前の化合物を投与しているため、この条件では譲渡できない)、基本的には各国の法律や規則、大学や企業の動物実験委員会での規程など厳格なルールのもとに動物を選定する必要があることが分かります。
先にも述べたように里親制度が出来たことで実験動物を譲渡することで救われる命がある一方、命の選別をしなければならない実験従事者がいるのも事実です。彼らの精神的負担を軽減するためにも譲渡動物選定における明快なルールの策定と、実験動物の里親制度の更なるブラッシュアップが求められています。
コラム 実験動物

ARRIVEガイドライン2.0が公開されました
7月14日にNC3Rs(英国3Rセンター)にてARRIVEガイドライン2.0が公開(https://arriveguidelines.org/)されました。2010年に初めて公開されたARRIVEガイドラインは、動物実験計画において最低限記載すべき項目をまとめたものであり、Natureをはじめ多くの学術雑誌に支持されているガイドラインです。
そもそもこのガイドラインが作成された背景には、動物実験の再現性があまりにも低い(一説には70%以上の実験が再現できない)と言われてきたことがあります。その一因として実験方法の詳細が述べられていないとの指摘がありました。
英国の機関が、動物実験の記載がある271報(1999-2005)の論文を精査したところ、研究の仮説・目的を記載し、かつ動物の数と特徴が記載されていたのは271報のうち、わずか59%であったことを報告(https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0007824)しています。
これらの事を受けてNC3Rsは記載すべき20の項目を定めて2010年にARRIVEガイドラインとして発表しました。多くの研究機関や出版社から支持されてきたものの、記載項目が多いことからも問題の根本的な解決には至りませんでした。そこで改訂版であるARRIVEガイドライン2.0が新たに公開されました。
ARRIVEガイドライン2.0の主な変更点は以下のとおりです。
記載すべき最低限の項目を10項目に絞った「ARRIVE Essential 10」とそれらを補完する「Recommended Set」に分類した
ARRIVE Essential 10は以下のとおりです。なお正式な日本語訳は日本実験動物学会等、公的機関によるアナウンスをお待ちください。
1. Study design(研究計画)
2. Sample size(サンプルサイズ)
3. Inclusion and exclusion criteria(包含基準と除外基準)
4. Randomisation(ランダム化)
5. Blinding(盲検化)
6. Outcome measures(実験の帰結)
7. Statistical methods(統計学的方法)
8. Experimental animals(実験動物の情報)
9. Experimental procedures(実験処置)
10. Results(結果)
前回のガイドラインが20項目であったことからも項目数を絞って記載しやすくなっていることが分かります。通常の動物実験審査においては3~5の項目を審査することは少ないのですが、今後はこのあたりも審査することが求められてくるかもしれません。