- トップ
- コラム一覧
実験動物の記事一覧

最長寿齧歯類ハダカデバネズミの発がん・老化耐性機構の解明に向けて
熊本大学 大学院生命科学研究部 老化・健康長寿学講座
河村佳見
はじめに
キモかわいい動物として一部の層に人気を博しているハダカデバネズミ、皆さんは実際に見たことがあるでしょうか。上野動物園や埼玉県こども動物自然公園、最近私たちの研究室から個体を譲渡した熊本市動植物園などで見ることができます。体長8−10 cm、体重35 g程度と小柄で、両手で餌をもってかじったり、仰向けで眠ったり、見ていて飽きない多彩な行動をとるからでしょうか。実際にハダカデバネズミを見た多くの人は、写真や動画で見るよりかわいらしいと感じるようです。
そんなハダカデバネズミは近年、医学研究においても注目されるようになってきました。なぜならハダカデバネズミは、上述のように実験用マウスと同程度の大きさの小型齧歯類であるにも関わらず、最大寿命が40年と、体重から推定される5倍以上の長寿を誇るからです。しかも、その生存期間の大部分の間、老化の兆候を示さず、さらにこれまで、発がんがほとんど確認されていません。このような特徴から、老化やがんを含む様々な加齢性疾患の「予防法」の開発につながる新たな実験動物として、大きく注目を集めています。本稿では、ハダカデバネズミの特徴や発がん耐性・老化耐性に関与する最近の知見について、私たちの研究の成果を交えながら紹介します。
ハダカデバネズミとは
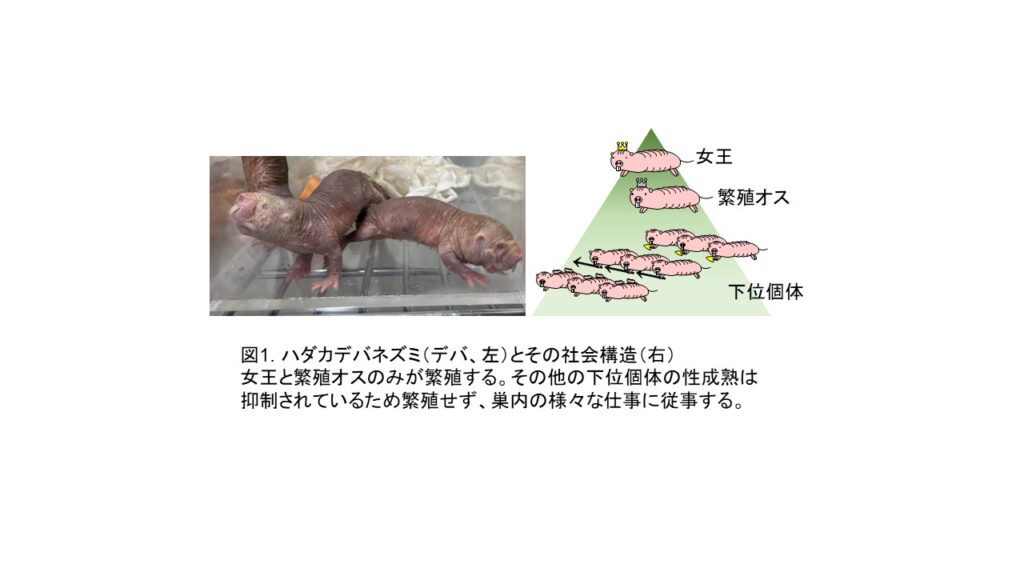
ハダカデバネズミ(図1左、デバ、英名naked mole-rat、学名 Heterocephalus glaber)はその名の通り無毛(完全に無毛ではなく、感覚毛がまばらに生えています)で、歯の突出したネズミです。デバは19世紀頃に初めて発見され、その見た目から当初は他の動物の赤ちゃんか、もしくは病気の動物ではないかと考えられたそうです1。分類上は齧歯目のヤマアラシ亜目デバネズミ上科のハダカデバネズミ科に属し、本種のみでハダカデバネズミ属を構成します。英名でラットと名前がついていますが、実験に用いられる齧歯類の中では、比較的モルモットに近い種です。野生ではアフリカの角(エチオピア・ケニア・ソマリア)と呼ばれる地域の乾燥地帯の地下にトンネルを掘り、アリの巣のような巣を作って住んでいます。住処だけでなく、その社会構造もアリに似ています。デバは哺乳類では極めて珍しい分業制の社会(真社会性)を作り(図1右)、数十から100匹以上の集団(コロニー)で生活しています2。1つのコロニーの中では1匹の女王と1−3匹の繁殖オスのみが繁殖し、その他のメンバー(女王と繁殖オスの子どもたち)は雌雄ともに性成熟が抑制されていて、働きデバとして餌集めやトンネル掘り、女王が生んだ子供の世話など様々な仕事を行います。女王は働きデバの性成熟を抑制していますが、そのメカニズムの詳細はまだよくわかっていません。女王から働きデバを隔離すると性成熟が開始すること、隔離した働きデバを女王の糞尿がついた床敷に曝露しても性成熟は抑制されないことなどから3、女王との物理的な接触(小突き行動などの攻撃的な接触)が重要ではないかと考えられています4。
このようなデバの特殊な生態は、研究者たちの関心を集め、1970年代頃から地下性哺乳類の生態学的研究の一環として、実験室で飼育されるようになりました。その後、実験室での飼育によって、さらに驚くべき事実が明らかになりました。野生から捕獲されたデバが、20年を経過してもなお生存していたのです。さらに個体老化の指標として重要な加齢に伴う死亡率の上昇が認められず、加齢による各種生理機能(活動量・繁殖能力・心臓拡張機能・血管機能など)の低下もほとんど見られませんでした。加えて2000例以上の観察において腫瘍形成がほとんど認められないという、顕著な発がん耐性を示すことが判明しました5。このような老化やがんをはじめとする加齢性疾患耐性の分子メカニズムを解明することは、ヒトにおける老化やがんの予防方法の開発につながる可能性があるため、デバを用いた分子生物学的研究が近年盛んに行われるようになってきました。
デバ個体における発がん耐性メカニズム
観察研究によりデバの発がん耐性が明らかになって以来、そのメカニズムを解明するために、主に培養細胞を用いた研究が行われてきました。これまでに、デバの線維芽細胞にがん遺伝子である恒常活性化型Ras(HRAS-V12)およびSimian Virus 40 Large T(SV40LT)抗原を導入してがん化への形質転換を試みたところ、これらの細胞は形質転換に対して抵抗性を示し6、その耐性機構には高分子量ヒアルロン酸の存在が必要であることが報告されています7。一方で、近年では他の研究グループから、HRAS-V12とSV40LTの導入のみでデバ線維芽細胞ががん化形質転換するという、先行研究と異なる報告もなされており、デバの細胞がこのような遺伝子導入によるがん化誘導にどの程度耐性を持つのかについては現在も議論が続いています8,9。
一方、デバの発がん耐性を評価するためには、自然発がんの発生率の観察や細胞レベルでの解析に加えて、生体内で実験的に発がんを誘導し、組織の応答を評価することが重要です。そこで私たちは、デバ個体に対して、発がん剤である3-メチルコラントレン(3-MC)または7,12-dimethylbenz[a]anthracene (DMBA)/ 12-O-tetradecanoylphorbol-13-acetate (TPA)を用いた、2種類の化学発がんモデルによるがん誘導実験を行いました10。その結果、マウスでは両方の誘導法において30週以内にすべての個体で腫瘍が形成されたのに対し、デバでは2年以上にわたる長期観察の中で、いずれの個体にも腫瘍の発生は認められませんでした。つまり、デバは化学的な発がん誘導に対しても極めて高い耐性を示すことが明らかとなりました。
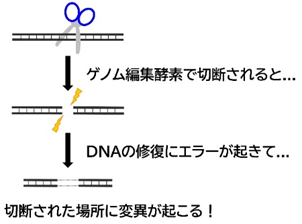
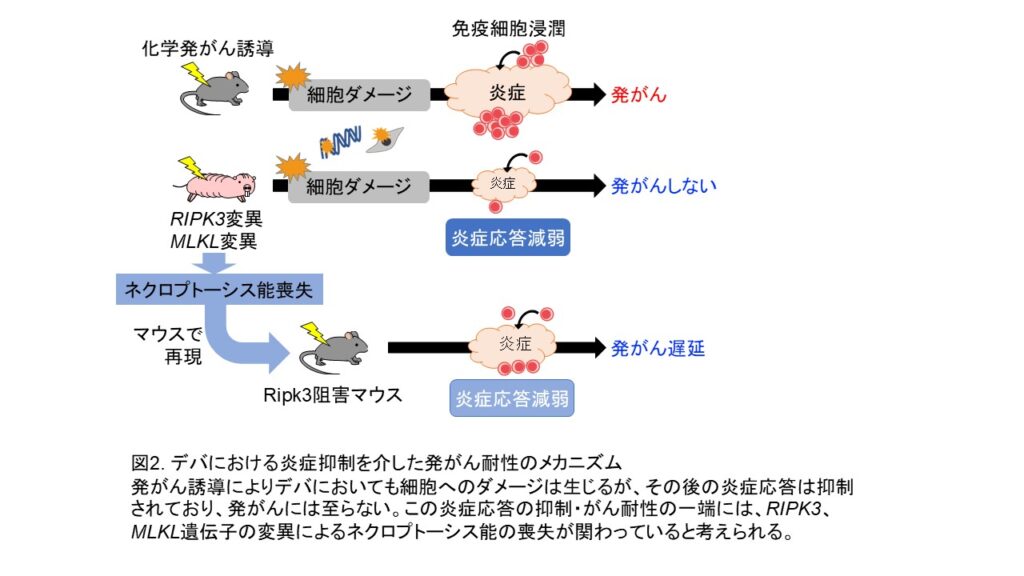
発がんの過程では一般的に、DNA損傷や配列変異により変異細胞の出現(イニシエーション)が起こり、続いて免疫細胞の浸潤を伴う炎症の亢進などの組織微小環境の変化(プロモーション)が生じて発がんが促進されます。デバでは、発がん剤によるDNA損傷や細胞死は起こるものの、マウスと比べて免疫細胞の浸潤が少なく、炎症応答が弱まっていると考えられました。この炎症応答の減弱のメカニズムを解析するために、発がん誘導時の遺伝子発現変化をマウスとデバで比較しました。その結果、マウスでは“ネクロプトーシス”と呼ばれる細胞死を引き起こす遺伝子発現変化が生じていた一方で、デバではそのような変化は見られませんでした。ネクロプトーシスはプログラムされた細胞死の一種で、細胞膜の破裂とDNAなどの細胞内物質の放出を伴うため、強い炎症応答を引き起こします。デバでネクロプトーシス経路の活性化が見られない原因を探索したところ、ネクロプトーシスの制御遺伝子であるRIPK3およびMLKLにフレームシフト変異が生じており、ネクロプトーシスを誘導する機能を失っていることが判明しました。
そこで、マウスにおいてRipk3を阻害または欠損させ、3-MCによる発がん誘導を行ったところ、3-MC投与後の免疫細胞の浸潤が抑えられ、さらに腫瘍の発生も遅くなることが明らかとなりました。これらの結果から、デバにおけるネクロプトーシス誘導能の喪失は、発がんプロモーションとして働く炎症を抑えることで、発がん耐性の一因として機能していると考えられます(図2)。とはいえ、この変異のみではデバの強い発がん耐性を完全には再現できません。発がんの過程は、変異細胞とそれを取り巻く微小環境との相互作用によって進行すると考えられているため、未解明の発がん抑制機構を明らかにするには、今後さらに個体および組織レベルでの詳細な解析が重要となります。
コラム実験動物

動物福祉の評価ツールのご紹介-3 福祉を評価するツールを紹介するサイト2: NC3Rsの Welfare Assessment
前回の「動物福祉の評価ツールのご紹介-2」では、米国農務省USDAの“National Agricultural Library”の中にある“Animal Welfare Assessments” について紹介しました。
今回は、英国のNC3Rs(The National Centre for the Replacement, Refinement & Reduction of Animals in Research)が作成したガイドライン“Welfare Assessment”について紹介します。この文書は、USDAのNational Agricultural Libraryの中では”Welfare Assessments”として示されていて、前回は、このガイドラインが以下の情報を提供していることを報告しました。
●福祉指標の策定
●実際上の侵襲性(物理的および心理的傷害)の評価と報告
●適切な記録の保管方法とそのレビュー
●スタッフのトレーニング
今回は、それぞれの項についてもう少し踏み込んでいきます。

動物福祉の評価ツールのご紹介-2
〜福祉を評価するツールを紹介するサイト1:USDAのNational Agricultural Library〜
前回の「動物福祉の評価ツールのご紹介-1」では、本シリーズのイントロダクションとして、AVMA((American Veterinary Medical Association)主催の“学生動物福祉状況の評価コンテスト”を扱いました。
今回は、福祉を評価するツールを紹介するウェブサイトの第一弾として、アメリカ農務省(USDA, United States Department of Agriculture)の国立農業図書館(National Agricultural Library)に格納されている“Animal Welfare Assessments”のウェブページ(下図)を紹介していきたいと思います。
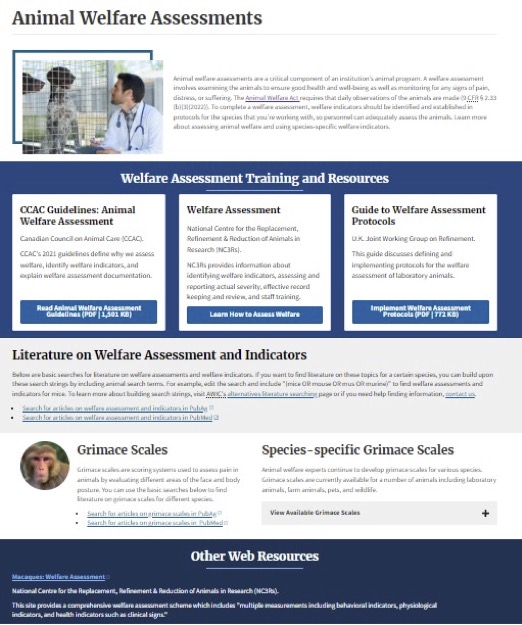
“Animal Welfare Assessments”のページはいくつかのパートに分かれ、“Welfare Assessment Training and Resources”(動物福祉の評価のトレーニングとリソース)、“Literature on Welfare Assessment and Indicators”(動物福祉の評価と指標に関する文献へのリンク集)、“Grimace Scale”(グリマス(しかめっつら)スケール)などが掲載されています。以下、掲載されている情報を順番に説明してみます。なお、情報は2023年1月現在のものです。

動物福祉の評価ツールのご紹介-1
〜AVMA主催の“学生動物福祉状況の評価コンテスト”〜
動物の福祉状況を良くしていこうと言われていますが、日本では、法律、指針や、日本学術会議のガイドラインにおいて、動物の福祉状況に関する評価方法の、簡便で使いやすい具体的な記述・指標は見当たりません。特に動物実験においては、法規制が求めるところが機関管理なので、具体的な記述や指標を設定することにむずかしいところがあることも理解ができますが、動物実験を管理し施行状況の評価を任される立場の視点から見ると、もう少し情報が欲しいところです。
実験動物の福祉状況の評価について世界に目を向けると、2014年にTexas A&M UniversityのBonnie V. BeaverとAAALAC InternationalのKathryn Bayneが、“Animal Welfare Assessment Considerations”1)という記事で評価法を公開しています。本コラムでは、数回にわたって、この視点から少し深堀りしてみましょう。
まず触れたいのは、“北米で、学生を対象とした動物福祉状況の評価コンテストが行われる”ことを紹介したイリノイ大学のニュース2)です。学生だけでなく、私たち実験動物医学の専門家の能力向上にも役立つのではないかと思い、紹介することにしてみました。
AVMAが学生対象に動物福祉評価コンテストを開催
イリノイ大学のニュースが詳しく紹介していたのは、AVMA(American Veterinary Medical Association)が先月(2022年11月)に開催した、“学生を対象とした動物福祉評価コンテスト:ANIMAL WELFARE ASSESSMENT CONTEST” 3)(下図は、その登録募集のチラシのコピー)についてです。本コンテストは、もともとミシガン州立大学(MSU)とパデュー大学の教員が提案し、2002年にMSU、ゲルフ大学、ウィスコンシン大学、パデュー大学の代表4チームが集まって始めた小さなコンテストから始まりました。これが、2014年には、北米各地の学校から合計28チーム、116名の参加者を集めるようになり、いまの形になったとのことです。当初は対象動物を家畜としていましたが、現在では、生産動物、コンパニオンアニマル、実験動物、エキゾチックアニマルにまで拡大しています。今年(2022年)の動物種には、展示用に飼育された鶏(愛玩用)、乳用牛(主に搾乳群に入らないオス)、水族館のタコが含まれます。仮想のしなりを設定は、アニマルシェルターの犬・猫です。参加者は、輸送、住居、健康、トレーニング、退役 、生産、屠殺/安楽死など、各動物種の生活のすべての側面における福祉を評価することになっています。頭足類を評価の対象に入れるところは、AVMAが時代の趨勢を敏感に反映していこうとする姿勢がうかがえます。このような先取の精神には見習う点があります。


米国獣医学会(AVMA)動物の安楽死指針2020年版出版記念 -紹介動画-
日本実験動物医学専門医協会は、AVMAと翻訳契約を取り交わし、「米国獣医学会 動物の安楽死指針(安楽死ガイドライン):2020年」版の翻訳本(翻訳者代表 黒澤努、鈴木真)を出版しました。本ガイドラインは、国際的に容認される具体的な安楽死法を示しており、主に獣医師を対象に記載されています。専門的ではありますが、最新の情報を網羅しており、獣医師以外の動物にかかわる方々の指針としても重要な文献です。(原文はこちら)
2013年度版から改訂された2020年版では、第3章にS1コンパニオンアニマル、S2実験動物、S3家畜、S4馬、S5鳥類、S6魚類と水生無脊椎動物、S7野生動物と7つの動物に区分されて記載されています。
日本実験動物医学会および日本実験動物医学専門医協会は、本指針が広く周知されることで、わが国の動物福祉がより向上することを期待します。また、実験動物ならびにその他の動物の人道的な取り扱いを広めるための啓蒙活動を継続していきます。
米国獣医学会(AVMA)動物の安楽死指針(安楽死ガイドライン)2020年版の紹介
炭酸ガスを用いた安楽死
Compassion Fatigue(共感疲労)
Compassion Fatigueについて、さらに知りたい方はこちらもご覧ください。