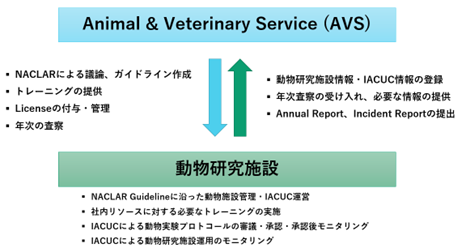
- トップ
- コラム一覧
海外の記事一覧

動物福祉の評価ツールのご紹介-3 福祉を評価するツールを紹介するサイト2: NC3Rsの Welfare Assessment
前回の「動物福祉の評価ツールのご紹介-2」では、米国農務省USDAの“National Agricultural Library”の中にある“Animal Welfare Assessments” について紹介しました。
今回は、英国のNC3Rs(The National Centre for the Replacement, Refinement & Reduction of Animals in Research)が作成したガイドライン“Welfare Assessment”について紹介します。この文書は、USDAのNational Agricultural Libraryの中では”Welfare Assessments”として示されていて、前回は、このガイドラインが以下の情報を提供していることを報告しました。
●福祉指標の策定
●実際上の侵襲性(物理的および心理的傷害)の評価と報告
●適切な記録の保管方法とそのレビュー
●スタッフのトレーニング
今回は、それぞれの項についてもう少し踏み込んでいきます。

動物福祉の評価ツールのご紹介-2
〜福祉を評価するツールを紹介するサイト1:USDAのNational Agricultural Library〜
前回の「動物福祉の評価ツールのご紹介-1」では、本シリーズのイントロダクションとして、AVMA((American Veterinary Medical Association)主催の“学生動物福祉状況の評価コンテスト”を扱いました。
今回は、福祉を評価するツールを紹介するウェブサイトの第一弾として、アメリカ農務省(USDA, United States Department of Agriculture)の国立農業図書館(National Agricultural Library)に格納されている“Animal Welfare Assessments”のウェブページ(下図)を紹介していきたいと思います。
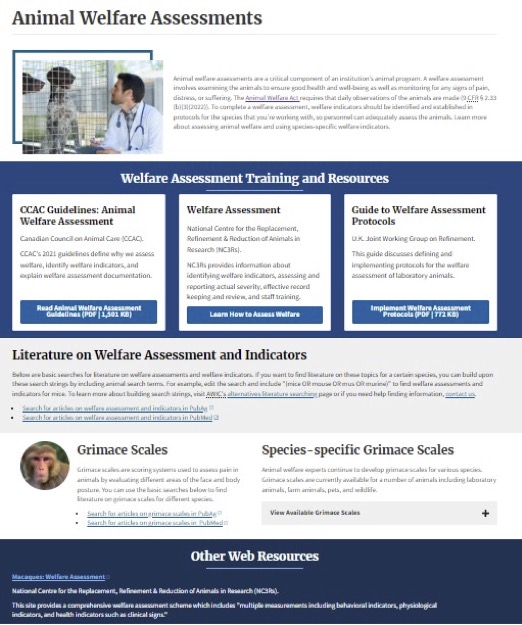
“Animal Welfare Assessments”のページはいくつかのパートに分かれ、“Welfare Assessment Training and Resources”(動物福祉の評価のトレーニングとリソース)、“Literature on Welfare Assessment and Indicators”(動物福祉の評価と指標に関する文献へのリンク集)、“Grimace Scale”(グリマス(しかめっつら)スケール)などが掲載されています。以下、掲載されている情報を順番に説明してみます。なお、情報は2023年1月現在のものです。

動物福祉の評価ツールのご紹介-1
〜AVMA主催の“学生動物福祉状況の評価コンテスト”〜
動物の福祉状況を良くしていこうと言われていますが、日本では、法律、指針や、日本学術会議のガイドラインにおいて、動物の福祉状況に関する評価方法の、簡便で使いやすい具体的な記述・指標は見当たりません。特に動物実験においては、法規制が求めるところが機関管理なので、具体的な記述や指標を設定することにむずかしいところがあることも理解ができますが、動物実験を管理し施行状況の評価を任される立場の視点から見ると、もう少し情報が欲しいところです。
実験動物の福祉状況の評価について世界に目を向けると、2014年にTexas A&M UniversityのBonnie V. BeaverとAAALAC InternationalのKathryn Bayneが、“Animal Welfare Assessment Considerations”1)という記事で評価法を公開しています。本コラムでは、数回にわたって、この視点から少し深堀りしてみましょう。
まず触れたいのは、“北米で、学生を対象とした動物福祉状況の評価コンテストが行われる”ことを紹介したイリノイ大学のニュース2)です。学生だけでなく、私たち実験動物医学の専門家の能力向上にも役立つのではないかと思い、紹介することにしてみました。
AVMAが学生対象に動物福祉評価コンテストを開催
イリノイ大学のニュースが詳しく紹介していたのは、AVMA(American Veterinary Medical Association)が先月(2022年11月)に開催した、“学生を対象とした動物福祉評価コンテスト:ANIMAL WELFARE ASSESSMENT CONTEST” 3)(下図は、その登録募集のチラシのコピー)についてです。本コンテストは、もともとミシガン州立大学(MSU)とパデュー大学の教員が提案し、2002年にMSU、ゲルフ大学、ウィスコンシン大学、パデュー大学の代表4チームが集まって始めた小さなコンテストから始まりました。これが、2014年には、北米各地の学校から合計28チーム、116名の参加者を集めるようになり、いまの形になったとのことです。当初は対象動物を家畜としていましたが、現在では、生産動物、コンパニオンアニマル、実験動物、エキゾチックアニマルにまで拡大しています。今年(2022年)の動物種には、展示用に飼育された鶏(愛玩用)、乳用牛(主に搾乳群に入らないオス)、水族館のタコが含まれます。仮想のしなりを設定は、アニマルシェルターの犬・猫です。参加者は、輸送、住居、健康、トレーニング、退役 、生産、屠殺/安楽死など、各動物種の生活のすべての側面における福祉を評価することになっています。頭足類を評価の対象に入れるところは、AVMAが時代の趨勢を敏感に反映していこうとする姿勢がうかがえます。このような先取の精神には見習う点があります。


米国獣医学会(AVMA)動物の安楽死指針2020年版出版記念 -紹介動画-
日本実験動物医学専門医協会は、AVMAと翻訳契約を取り交わし、「米国獣医学会 動物の安楽死指針(安楽死ガイドライン):2020年」版の翻訳本(翻訳者代表 黒澤努、鈴木真)を出版しました。本ガイドラインは、国際的に容認される具体的な安楽死法を示しており、主に獣医師を対象に記載されています。専門的ではありますが、最新の情報を網羅しており、獣医師以外の動物にかかわる方々の指針としても重要な文献です。(原文はこちら)
2013年度版から改訂された2020年版では、第3章にS1コンパニオンアニマル、S2実験動物、S3家畜、S4馬、S5鳥類、S6魚類と水生無脊椎動物、S7野生動物と7つの動物に区分されて記載されています。
日本実験動物医学会および日本実験動物医学専門医協会は、本指針が広く周知されることで、わが国の動物福祉がより向上することを期待します。また、実験動物ならびにその他の動物の人道的な取り扱いを広めるための啓蒙活動を継続していきます。
米国獣医学会(AVMA)動物の安楽死指針(安楽死ガイドライン)2020年版の紹介
炭酸ガスを用いた安楽死
Compassion Fatigue(共感疲労)
Compassion Fatigueについて、さらに知りたい方はこちらもご覧ください。