- トップ
- コラム一覧
実験動物の記事一覧

遺伝性疾患の研究における実験動物の役割と課題〜筋ジストロフィーモデル動物を例に〜
1. 遺伝子変異の解析とモデル動物の作製
筋ジストロフィーは、40種類以上の遺伝子のいずれかに変異が生じて発症する遺伝性筋疾患の総称です(1)。原因遺伝子によって違いはありますが、進行性の筋力低下と骨格筋の組織変性を主徴とする致死的な疾患です。患者数が最も多いデュシェンヌ型筋ジストロフィー(DMD)は、筋細胞膜の構造維持に不可欠な蛋白質をコードするジストロフィン(DMD)遺伝子の変異が原因で発症するX連鎖劣性遺伝疾患です(2)。DMD遺伝子は78個のエクソンから構成される全長2.4 Mbの巨大な遺伝子です。このような巨大な遺伝子上に多様な変異が様々な箇所に生じるため、診断や治療法の開発が困難となっています。
DMD遺伝子の変異の型は、コドンの読み枠がずれる「アウト・オブ・フレーム型」と読み枠が維持される「イン・フレーム型」に大別されます。前者のアウト・オブ・フレーム型変異ではジストロフィン蛋白質が産生されないため重症のDMDとなりますが、後者のイン・フレーム型変異では短いジストロフィンが産生されるため、多くは軽症のベッカー型筋ジストロフィー(BMD)と診断されます。これらの型はさらに欠失や重複、点変異など様々な変異によって生じるだけでなく、現在では変異パターンに応じて予後が異なることが明らかとなりつつあります(3)。変異の種類に応じた病態を理解するためには、患者と同様な変異を持つ遺伝子改変動物が必要です。しかし、欠失だけでも500種類以上が報告されている変異に対して、それぞれのモデル動物を作製することは現実的ではありません。そこで活躍するのが、遺伝子変異の種類や頻度、症状などの様々な情報がまとめられているデータベースです。DMDを含む遺伝性筋疾患の分野においてもいくつかの国家規模または国際的規模のデータベースを利用することできます(3)。このような情報を利用することで、発生頻度の高い変異や重症度を調べることができます。すなわち、無数にある変異の中から「どのような変異を持つモデル動物を作製すべきか」の指針となる情報が得られる場合があります(図1)。
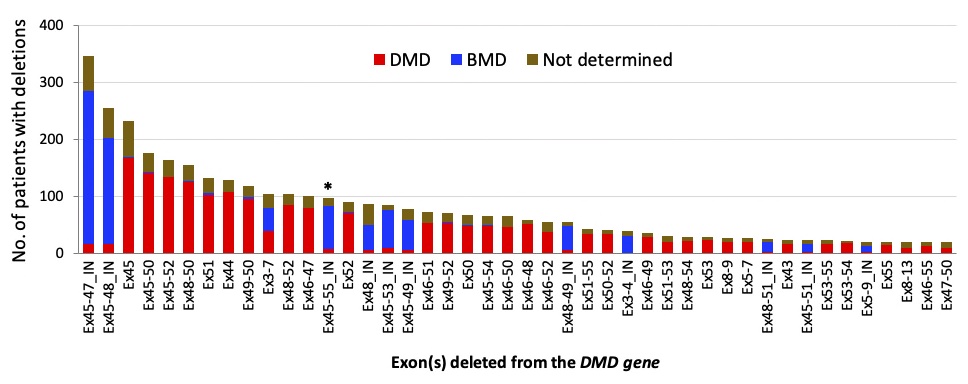
図1 遺伝性疾患の国際的open database(LOVD: https://www.lovd.nl/)を用いて解析されたDMD遺伝子の欠失変異の頻度と重症度スペクトラム。赤は重症のDMD、青は軽症のBMDを示す。Ex, エクソン(数字は欠失したエクソンの番号); IN, イン・フレーム変異(短縮型ジストロフィンの産生が可能な変異)。記載のない項目は全てジストロフィンを産生できないアウト・オブ・フレーム変異を示す。Echigoya Y, et al. J Pers Med. 2018, licensed under CC BY 4.0.

【Webinar】マウスの環境エンリッチメントと老齢モデルコロニーの維持(EPトレーディング株式会社提供)
実験動物の特殊飼料やエンリッチメント、水分・栄養補給用ジェルなどを取り扱っているEPトレーディング株式会社(https://www.eptrading.co.jp/index.html)に、JALAMのために日本語字幕付きWebinar動画をご提供いただきました。

AALAS(米国実験動物学会)2020で行った、ジャクソンラボラトリー Dr.Schile による「環境エンリッチメントと繁殖」、「老齢モデルコロニー の維持」の解説ビデオ(51分)
https://www.eptrading.co.jp/service/ssp/video.html

実験動物のリホーミング
最近では、酪農学園大学から引き取られた実験犬「しょうゆ」の里親譲渡の話題もあり、こちらも「実験動物の里親制度」についてのコラムですでに紹介されていますが、国内でも少なからず実験動物を安楽死せずに余生を送らせるリホーミングの活動が行われています。リホーミングは動物の福祉を考えること、また実施者の心理的負担を軽減させるという点でとても有意義なことではありますが、同時に、実験動物が社会の目に触れ、動物実験に関心をもつきっかけとなるということは、社会的に適正な動物実験を考える上でもとても重要なことでもあるのではないでしょうか。
ここでは実験動物のエンドポイントとして安楽死に代わる選択肢としての可能性があるリホーミングについて、実際にリホーミングをされた方からの寄稿を交えて、文献を紹介します。多くの方が実験動物に関心を持ち、適正な動物実験を考えるきっかけとなればと思います。
文献紹介:リホームされた実験用ビーグルは、日常的な場面でどのような行動をとるのか?
製薬企業から引き取られた実験犬の、その後に関するドイツでの調査です。
文献紹介:英国で行われた実験動物のリホーミング実践に関する調査
実験動物のリホーミングに関する英国での実態調査です。
文献紹介:フィンランドにおける実験用ビーグルの最初のリホーミング:社会化訓練からフォローアップまでの完全なプロセス
フィンランドで行われた実験用ビーグルの最初のリホーミングと社会化プログラムの紹介です。

愛玩動物看護師の国家資格化に向けて
これまで獣医療に関する国家資格保有者は獣医師のみでしたが、このたび新たに動物看護師が「愛玩動物看護師」との名称で国家資格化されることが決定しました。この国家資格化には、獣医師法と現在の臨床現場における乖離が問題視されてきたことが背景にあります。
獣医師法は獣医師全般の職務・資格などに関して規定した法律ですが、臨床現場において獣医師以外の診療行為(採血、調剤、投薬、麻酔、レントゲン撮影など)を認めていません。しかし獣医師のみでこれら業務を対応するのは難しく、動物看護師によるこれら診療行為が黙認されている動物病院があることも以前から言われてきました。これらの声に対応すべく、医療現場における医師と看護師の関係のように、動物看護師が獣医師の指示の下で適切に診療の補助行為が行えるようにするため国家資格化されるとのことです。
では現在、環境省の愛玩動物看護師カリキュラム等検討会で審議されている、今後のスケジュールについて見ていきましょう。
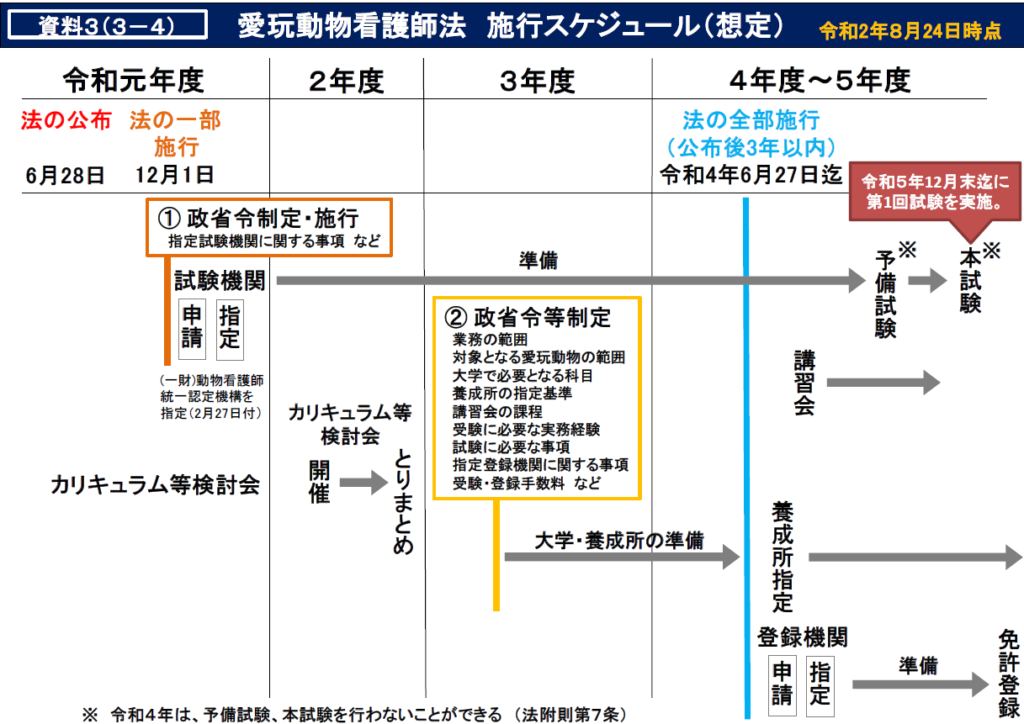
http://www.env.go.jp/nature/dobutsu/aigo/2_data/kangoshi/01.html
国家資格化されるということで、大きく変わることとしては国家試験が新たに作られます。これまでも公的資格化を目指して認定試験が行われてきましたが、診療補助行為が新たに認められることから、そのカリキュラムや試験内容は大幅に異なってくることが予想されます。基本的には大学や養成所指定された専門学校でコアカリキュラムをこれから学ぶ受験資格がありますが、既卒の方などには講習会に参加したり実務経験を証明することにより受験資格を与えられるとなっています。
また、愛玩動物看護師は臨床現場だけでなく、様々な場面での活躍が期待されています。具体的には、動物愛護管理法(動愛法)の中の「動物取扱責任者」の要件を見直し、愛玩動物看護師を加えることで、ペットショップやブリーダー等の第一種動物取扱業者が事業所ごとに選任義務のある「動物取扱責任者」として新たに動物愛護看護師の資格保有者を選任できるようにするとのことです。つまりはペットを扱う現場においては愛玩動物看護師などがいることが望ましいということですね。
愛玩動物看護師には私たち実験動物分野での活躍も期待しています。私たちの分野では「実験動物技術者」という資格が非常に重宝されています。動物福祉に対する考えや高度な実験技術などから資格保有者に対しては一定のレベルが担保されているとのことからの信頼なのですが、ここに新たに愛玩動物看護師の方のペットの目線からの動物福祉であったり、採血・投薬技術などが加わることで特に中大動物の動物福祉が一層進むのではないかと考えています。

コラム実験動物

創薬に関わる特殊な実験動物たち
そして個人的には前から気になっている疾患モデル動物に「カイコ」がいます。

東大の名誉教授で、現在は帝京大学で研究されている先生が主体的に動いているプロジェクトなのですが、黄色ブドウ球菌などの細菌感染モデルや、カンジダなどの深在性真菌症のモデルも有しているとのことです。さらに薬物の静脈内投与、経口投与も可能(下図)とのことで、基本的な実験動物の要素は兼ね備えているように思いますが、あとは動物をいかにして安定供給できるかといったところでしょうか。試験を回していく上でこの部分はかなり重要ですので、本気でスクリーニング系として用いるのであれば飼育形態含め、色々と考えなければならない部分が多そうです。

http://www.genome-pharm.jp/
現在、ヨーロッパの動物実験ではイヌの使用が減って、逆にブタの使用が増えているとのことです。様々な理由が挙げられていますが、ペットとして用いられるような動物を使用するのは可哀そうといった感情論によるものが大きいと感じています。今はまだ小型魚類や虫を実験動物として使用することに反対は少ないと思いますが、近い将来、これらの動物であっても使用することが難しくなってくるのかもしれませんね。
コラム実験動物