- トップ
- コラム一覧

動物福祉の評価ツールのご紹介-1
〜AVMA主催の“学生動物福祉状況の評価コンテスト”〜
さて、イリノイ大のニュースによると、このコンテストの目的は、「農業、研究、伴侶など、人間のために使用される動物に影響を与える福祉問題の理解と認識を高めるための教育ツールを経験することであり、倫理的推論に対する理解の上に、科学的理論とデータに基づいた動物福祉の客観的評価を促し、批判的思考を促進し、コミュニケーション能力を向上させる」ことです。参加対象は、3・4年学部生、獣医学部生、院生(1チーム3-5人)であり、動物看護師やAVMA会員の獣医師も少数に限り参加できます(ただし、コンテストの対象外)。参加者はいくつかのシナリオに沿って出題される動物とその福祉状況を分析して、その中から優れたシナリオを選び出し、発表するというものです。
ニュースでは、“動物福祉のさまざまな事象をそのときどきの断片として客観的かつ定量的に評価することも可能ですが、福祉問題は連続したものであり、どのあたりで許容できるか、どのあたりが好ましいか、または許容できないかの判断は、多くの場合、倫理に基づく選択に帰着するものです。コンテストでは、問題解決へ学際的にアプローチするため、科学に基づく知識を倫理的価値観と統合することを学生に教えています”という風に審査の方法について説明しています。私たちが学生の動物福祉評価を審査するのであれば、北米でどのような基準やチェック方法に従って動物福祉が評価されているのかの具体例を知りたいところです。
今回はこのくらいにさせていただいて、次は、動物福祉評価のツールについて整理していきたいと思います。
参考文献
1) Beaver B. V. and Bayne K, Chapter 4 – Animal Welfare Assessment Considerations, Laboratory Animal Welfare, 29-38 (2014)
2) Animal welfare judging team provides unique experiential learning for students. (cited 2022. Oct.28)
3) AVMA Animal Welfare Assessment Contest. (cited 2022. Dec. 05)

実験動物の飼育環境
Cedars-Sinai Medical Centerの研究グループは、日和見病原性真菌であるカンジダ菌がマウス腸内に存在しており、DSS投与で大腸上皮が傷害を受けバリア機能が破綻した際にデクチン1が存在しないとカンジダ菌をうまく排除出来ずに炎症が増悪化すると説明していました。これはヒトMRUC患者でも同様に説明可能とのことでした。デクチン1は特定の真菌に対する自然免疫センサー分子としての役割を持っていることから、まさに予想されうる結果です。一方、私たちの動物は極めてクリーンな環境で飼育していたことから腸内真菌が存在せず、このような増悪化は起こりようがなかったのです。そのため、デクチン1の持つ別の機能によって腸管が抗炎症の状態になっていたのです(詳細については参考文献5,6,7をお読みください)。
3. 最後に
私たちは、再現性のある質の高い動物実験を担保するために、実験動物をクリーンな状態を保ちながら大切に飼育しています。これはがん研究や再生医療研究には欠かせないものなのですが、免疫学などに関係する研究を行う際には、少し注意が必要です。SPF環境で飼育されたマウスの免疫状態は、ヒトでいうと未成熟な幼児の状態に近いとの報告もなされています(8)。すなわち、病態を発現させるため“ちょうどよい”程度の感染症(環境微生物)への暴露も必要という概念もあると思うのですが、それをコントロールし、さまざまな研究に対して適切な環境を一律に提供するというのは現実的ではないのかもしれません。
最近、コロナ感染を防ぐ目的による過剰な対応(行き過ぎた清潔な環境維持)のため、子供たちが幼少期にかかることの多い疾患(サイトメガロウイルス、EBウイルス、トキソプラズマなど)にかからずに大人になってしまうことが想定されており、将来の危険性が憂慮されています。
ヒトの現実社会も、実験動物の衛生管理も、一筋縄ではいきませんね。
4. 参考文献
1. 実験動物の飼養及び保管並びに苦痛の軽減に関する基準 (環境省)
https://www.env.go.jp/nature/dobutsu/aigo/2_data/nt_h180428_88.html (cited 2022. Sept. 29)
2. 実験動物の飼養及び保管並びに苦痛の軽減に関する基準の解説 (環境省)
https://www.env.go.jp/nature/dobutsu/aigo/2_data/pamph/h2911.html (cited 2022. Sept. 29)
3. 六匹のマウスから―「私史」日本の実験動物・45年 講談社(1991)
4. Iliev I.D. et al., Interactions between commensal fungi and the C-type lectin receptor Dectin-1 influence colitis. Science 336(6086): 1314-17 (2012) DOI: 10.1126/science.1221789
5. Tang C. et al., Inhibition of Dectin-1 Signaling Ameliorates Colitis by Inducing Lactobacillus-Mediated Regulatory T Cell Expansion in the Intestine. Cell Host Microbe 18 (2): 183-97 (2015) DOI: 10.1016/j.chom.2015.07.003
6. 唐 策ら.低分子βグルカン摂取により炎症性腸疾患を予防,改善する 昆布がお腹の調子を整える!—腸内細菌を介した分子機構の解明— 生物と化学 55(2): 128-34 (2017) DOI: 10.1271/kagakutoseibutsu.55.128
7. Iliev I.D. Dectin-1 Exerts Dual Control in the Gut. Cell Host Microbe 18 (2): 139-41 (2015) DOI: 10.1016/j.chom.2015.07.010
8. Beura L.K. et al., Normalizing the environment recapitulates adult human immune traits in laboratory mice. Nature 532(7600): 512-6 (2016) DOI: 10.1038/nature17655

国内承認ワクチンの非臨床試験を垣間見る 〜ワクチン開発と動物実験〜
日米EU医薬品規制調和国際会議(ICH)での合意に基づき、「医薬品の臨床試験のための非臨床試験の実施時期についてのガイドライン」が2010年に改正され、「医薬品の臨床試験及び製造販売承認申請のための非臨床安全性試験実施についてのガイダンス」がまとめられて現在に至っている (ICH-M3{R2})3)。この改正の主な目的は、承認審査資料の国際的なハーモナイゼーションを推進することにあり、「動物実験の3Rsの原則」に従うこと、および「早期探索的臨床試験のための非臨床試験」という概念を導入することなどにあり、これ以降、毒性試験や薬理試験など12の試験項目の安全性(Safety)についてICHガイドラインが各々整備されてきている (ICH-S1~S12)。
臨床第Ⅰ相試験の初期に実施される「早期探索的臨床試験」に応じて、ヒト初回投与試験までに実施すべきマイクロドーズ試験や単回投与毒性などの非臨床試験が、げっ歯類および非げっ歯類を用いて実施される。すなわち「早期探索的臨床試験の開始時までに実施される非臨床試験は一部にすぎず、実施予定の臨床試験の時期や期間に応じて非臨床試験がデザインされる」のが一般的である。
この分野の専門家ではない著者の私見ではあるが、「ほとんどの動物実験(試験)がヒト臨床に先だって実施されるもの」という、現実からやや乖離した先入観が社会の根底にあるように感じている。時に動物実験(試験)は「非臨床試験(前臨床試験)」などと記載されることもあり、研究者による社会に向けた正確な情報発信という点で誤解を生み易い表現には都度解説する必要があると自戒を込めて考えている。
【参考アドレス】
1. 独立行政法人医薬品医療機器総合機構(PMDA) 「医療用医薬品 情報検索」
2. 一般社団法人日本医薬情報センター(JAPIC) 「医薬品情報データベース (iyakuSearch)」
3. 独立行政法人医薬品医療機器総合機構(PMDA) 「ICH 医薬品規制調和国際会議 ガイドライン 」

マウスやラットの技術トレーニングで使用される代替法教材
2. 映像教材
実際に、動画による視覚的イメージが、技術の習得に大きく貢献することが、アメリカの獣医学生を対象とした調査で明らかとなっています。犬の外科手術の際に、教員の講義内容(声)、シュミュレーターでの練習内容、自らまとめたノート、動画教材の視覚的イメージなどの学習内容うち、記憶をどこからリコールしたかを調査したところ、動画の視覚的イメージと回答した学生が圧倒的に多かったと報告されています(2)。
映像教材はビデオカメラがあれば簡単に作成することが可能であり、各施設においてオリジナルの動画が作成・活用されています。また各種関連団体でマウスやラットの基本手技のDVDが販売されています。
映像教材と上述のシミュレーターと組み合わせることによって学習効果はさらに高まります。
・ビデオジャーナル:JoVE
JoVE(Journal of Visualized Experiments)は動物実験技術に限らず様々な分野の実験技術をマニュアル付きで多数公開している査読審査式のビデオジャーナルです。各実験技術の動画が専門家の解説付きでまとめられており、新しく実験系を立ち上げる際などに役立ちます。
JoVEに掲載されている実験動画の例:A Protocol for Housing Mice in an Enriched Environment
・解剖シミュレーションアプリ:3D Rat Anatomy
研究目的で解剖を行う際には、速やかかつ適切に臓器を採材することが要求されますが、そのためには各臓器の位置関係を理解しておく必要があります。3D Anatomyシリーズは3Dアプリの特性を利用することで、各臓器の立体的な位置関係を学習するのに有用な教材です。このシリーズでは犬や牛、鳥類をはじめとした様々な動物種のアプリがラインナップされていますが、小型齧歯類ではラットのアプリが販売されています。アプリはPC(WindowsおよびMacOS)、iPad、iPhone、Androidスマートフォンなど各種端末にダウンロードすることができます。3D Rat Anatomyは画面上の動物の各部位を拡大縮小、回転することができ、各器官の位置関係を容易に可視化することができます。また、骨、筋肉、内臓の透過度を調整したりすることで観察したい部位を強調することができます。なお3D Rat Anatomyは海外製品のため、器官名の表記がすべて英語となります。
biosphera HPにアプリのデモ動画が掲載されています。

[参考文献]
1. Corte GM, Humpenöder M, Pfützner M, Merle R, Wiegard M, Hohlbaum K, Richardson K, Thöne-Reineke C, Plendl J. Anatomical Evaluation of Rat and Mouse Simulators for Laboratory Animal Science Courses. Animals (Basel). 2021, 11(12):3432.
2. Langebæk R, Tanggaard L, Berendt M. Veterinary Students’ Recollection Methods for Surgical Procedures: A Qualitative Study. J Vet Med Educ. 2016, 43(1):64-70.

情報発信のあり方を考える
UARは他にも様々な活動を行っている。Webサイトには様々な情報や統計データ、国内外の実験動物を用いた研究に関するニュースが提供されている。様々な動物実験のプロトコールについて、目的や利点だけでなく苦痛についても紹介され、また、学生、ジャーナリスト、一般人向けに動物実験の情報を提供するウェブサイトanimalresearch. infoや、複数の動物施設のバーチャルツアーが体験できるlabanimaltour.orgも作成している。twitter等ソーシャルメディアも積極的に用い、多方面に情報提供を行っている(COVID-19のワクチンの開発過程における動物実験を行う意義について説明した図は、英国の多くのメディアでシェアされた)。
特に印象的な試みは、11〜18歳を対象に、UARがアンバサダーを学校に派遣し、ワークショップにて学生と”対話”することである。若年層ほど動物実験に抵抗を持っているので、将来を担う若者に正しい情報を隠すこと無く提供し、自発的に理解を深めてもらうことが目的である。人は一方的に事実を投げかけられても正しい判断を下すことができないため、学生との共通点や見解の一致点を探すことができる”対話”形式を用いている。年間1万人のペースで、すでに10万人以上の学生と対話を行ってきた。アンバサダーは動物実験の専門家(研究者、医療関係者、獣医師等)や動物飼育スタッフからなる167名のボランティアである。彼らは、効果的な対話法やプレゼン法の研修を受けた後に学校に派遣される。UARのHPには、学校向けコンテンツの一部が公開されている。学生アンケートの結果、アンバサダーのうち管理獣医師の話が最も信用できるとのことである。また、学生や先生方に動物実験施設見学の機会も設けている。
これらの試みによって、動物実験に関して英国民が入手できる情報は飛躍的に増え、事実を公表しても悪い影響や反発は起きていないこと、施設のHPで情報が豊富に入手できるため情報公開請求件数も減少し、動物実験に関するマスコミのネガティブな報道が大幅に減少したようだ。
本稿ではUARの試みの一部を紹介しましたが、動物実験の社会的理解を得るための情報発信のあり方について、議論のきっかけになっていただければ幸いです。
コラム 情報発信

研究者が実践するサイエンスコミュニケーション(後編)
他の人の意見を聞く
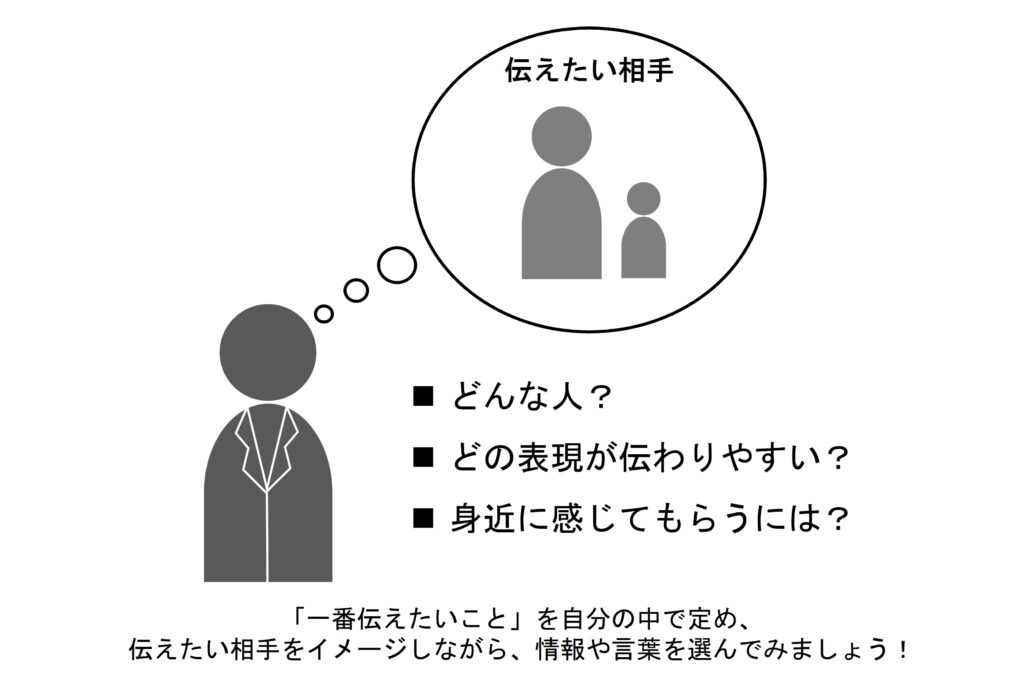
ピアレビューと言いますが、ある程度完成した作品を他の人に見せ、意見をもらう過程が非常に重要です。特に自分の研究に関連したことは、どの程度他の人が理解できるのか感覚が鈍っていたり、一般の認識とずれが生じていることがあります。通常、ピアとは「仲間や同僚」を意味しますが、必ずしも自分と立場の近い人を選ぶ必要はありません。逆にとても遠い立場の人にお願いする必要もなく、科学研究者であっても分野が異なれば「非専門家」であり、自分には見えない気付きをもたらしてくれるはずです。伝えたい層が明確であれば、その立場に近い人をピアとして選ぶのは情報の洗練に効果的です。
現時点の日本では、科学者が積極的にサイエンスコミュニケーション活動に参画する機会はあまりないかもしれません。一方、外部競争的資金を利用する場合など、社会への情報発信を義務付けているものもあります。また近年、クラウドファンディングによる研究資金の調達も活発化しており、科学に対する社会の関心や理解を得ることは、社会課題を解決するという大義に加え、研究費の獲得に繋がります。研究の持続的発展という観点では、子どもを含めた市民の関心が高まることで、次世代の優秀な研究者が育つことも期待できます。実際に英国では、このような多角的な視点から、科学者の多くはサイエンスコミュニケーション活動に前向きな姿勢を示しています。
科学者とサイエンスコミュニケーション
個人的な体感ですが、動物に関することは自然科学の中でも人々の関心が高く、その分、意見も多様化し、熱量も千差万別です。ただ、一般に大多数の人は動物のしあわせを願っていると私は考えています。動物実験/実験動物に関しては、世界中で常に議論がありますが、それに反対する人も科学者も、動物や人のしあわせといった、そう離れていない目標や信念を持っているのかもしれません。一方で、特定の意見こそなくても、私たちは日々、動物由来食品や製品、動物実験を経て開発された薬など、その恩恵を大いに享受して生きており、すべての人は動物に関する課題の利害関係者、ステークホルダーです。熱量の高い人だけでなく、すべてのステークホルダーがこの課題について考え、行動することが解決に必要であり、一科学者としては、サイエンスコミュニケーションを通じて多様な立場の人と情報を共有することがその一歩となると考えています。
大震災やパンデミックなど、危機的状況が発生したときのサイエンスコミュニケーションは、特にリスクコミュニケーションと呼ばれます。東日本大震災および福島第一原子力発電所事故時には、耳なじみのない専門用語が汎用されることで社会は混乱し、その重要性が強く認識されました。その反省も踏まえ、SARS-CoV-2による新型コロナウイルス感染症パンデミックでは、専門家や各学会が積極的に社会と情報を共有する動きがみられました。一方で、何が「正しい」情報なのか専門家も私たちも模索する日々を過ごし、昨日まで正しかったことが、今日から間違った情報になることを実体験しました。情報の正確性を高めるのは、真摯な科学研究による知見の蓄積しかありません。一方で、その伝え方や受け手のリテラシー、または社会的な文脈により、科学的に正しいことが社会の「正解」になるとは限らないことを、私たち研究者は意識する必要がある時代だと感じます。再生医療や人工知能など技術が高度・複雑化する一方、社会における理解と倫理的な議論が追い付いていない課題も多く、サイエンスコミュニケーションの拡がりにより、議論が活発化することを期待しています。
参考文献
1. 加納圭,水町衣里,岩崎琢哉,磯部洋明,川人よし恵,前波晴彦.サイエンスカフェ参加者のセグメンテーションとターゲティング : 「科学・技術への関与」という観点から.科学技術コミュニケーション 第13号.2013; 3-16.
コラム サイエンスコミュニケーション